Из чего сделаны растворы для контактных линз? — MKL.ua
Растворы для контактных линз сегодня повсеместно применяются для хранения и дезинфекции большинства видов мягких контактных линз (МКЛ). Не нуждаются в очистке только однодневные линзы. Контактная линза (КЛ) вне периода ее ношения на глазах обязательно должна храниться в растворе, поскольку находясь на воздухе она «высохнет» и безвозвратно испортиться уже через несколько часов.
Состав растворов для КЛ сложный, содержит много компонентов, каждый из которых имеет свое предназначение. По этой причине эти растворы также часто называют «многофункциональными» — ReNu MultiPlus, Maxima Elite, OPTI-FREE PureMoist, поскольку они совмещают функции очищения, увлажнения, дезинфекции и кондиционирования материала КЛ. Растворы для линз также часто называют «универсальными» — Aqua Soft Comfort, Multison, так как они подходят для обработки и гидрогелевых, и силикон-гидрогелевых МКЛ. Самостоятельно разобраться во всем многообразии многофункциональных растворов (МФР) представленных на рынке большим количеством производителей довольно сложно.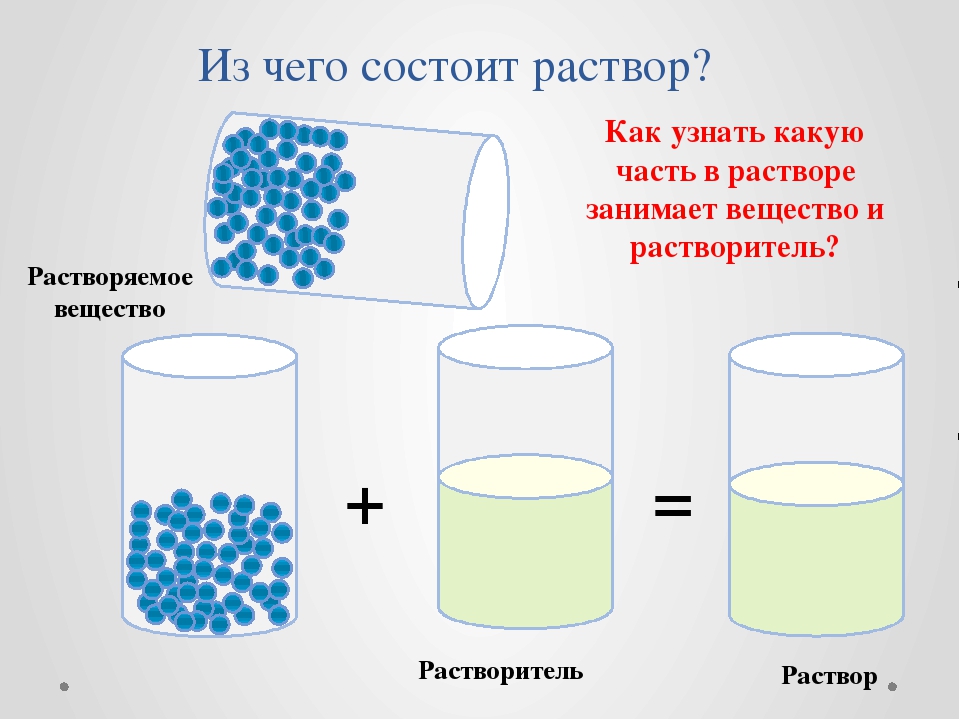
Солевой состав (осмотическое давление) и кислотность (рН) – два самых важных параметра для сохранения физических размеров контактных линз: толщины, диаметра и содержания влаги в материале, из которого изготовлены КЛ. Все без исключения растворы для контактных линз имеют физико-химические параметры близкие по составу к слезной жидкости. Если пренебречь этим важным требованием и попытаться хранить линзы в дистиллированной, проточной или прокипячённой воде, которые являются гипотоническими растворами, то линза станет впитывать в себя воду и «набухать». Понятно, что подобные перемены приводят не только к изменению оптической силы и базовой кривизны линзы, но также могут испортить и матрицу материала КЛ, после чего данное изделие навсегда придет в негодность. При помещении МКЛ в гипертонический (гиперосмолярный) раствор она будет отдавать влагу, и уменьшаться в толщине и диаметре, также теряя свои оптические свойства.
Другими компонентом растворов для линз являются сурфактанты – поверхностно-активные вещества (ПАВ), а попросту говоря – мыло. Как только КЛ попадает в глаз, практически сразу же на ее поверхности появляются отложения из компонентов слезной жидкости. Сурфактанты, которые предназначены для очистки и увлажнения КЛ, сами по себе, как правило, не достаточно эффективно справляются со своей функцией. Поэтому многие производители идут по пути увеличения их количества в растворе. Чем их больше, тем они лучше удаляют различные коллоидные, белковые и липидные загрязнения (отложения), а также в большей степени способствуют смачиваемости линз. Тем не менее, при использовании любой системы ухода, специалисты рекомендуют использовать дополнительную механическую очистку линз, даже если на флаконе указано «Без очистки» (No Rub) — OPTI-FREE EXPRESS, CyClean.
Третьим важным компонентом всех растворов для линз являются дезинфицирующие вещества (консерванты). Они должны снижать концентрацию микроорганизмов и предотвращать их размножение. Наиболее часто применяемые антибактериальные, противогрибковые и противопаразитарные вещества достаточно хорошо справляются со своей задачей, но при определенных условиях или в повышенных концентрациях они обладают негативным воздействием или на глаза, или на полимеры, из которых изготовлены КЛ. К наиболее часто применяемым консервантам относятся бензалконий хлорид (БАХ), поликвад, даймед, хлоргекидин (бигунид), перекись водорода (ПВ). ПВ, вернее его аналоги бербораты, не требующие нейтрализации, как антисептическое вещество используются в концентрациях ниже порога чувствительности тканей глаза, поэтому реакции гиперчувствительности на них практически не встречаются. Именно по этой причине растворы на основе перекиси водорода — EVER CLEAN, AOSept Plus HydraGlade, Peroxid пользуются большим успехом у обладателей чувствительных глаз.
Четвертым обязательным компонентом многофункциональных растворов является кондиционер, предназначенный для увлажнения и смазки. В самых современных растворах Unica Sensitive и Biotrue в качестве увлажнителя используется гиалуроновая кислота (ГК). Среди специалистов есть мнение, что повышенные содержания увлажняющих присадок – это комфорт на пять минут и риск дополнительного инфицирования, поскольку он ослабляет дезинфицирующие свойства раствора. Поэтому каждый пользователь должен знать, что если раствор для линз с гиалуроновой кислотой, то аккуратность должна быть идеальной.
Димексид 99% 100мл концентрат для приготовления раствора для наружного применения
Инструкция по применению Димексид 99% 100мл концентрат для приготовления раствора для наружного применения
Состав, форма выпуска и упаковка
Концентрат:
- Действующее вещество: диметилсульфоксид (димексид) — 50 мл или
100 мл.

По 50 мл и 100 мл во флаконы оранжевого стекла. Флакон вместе с инструкцией по применению помещают в пачку из картона.
Описание лекарственной формы
Бесцветная прозрачная жидкость или бесцветные кристаллы без запаха или со слабым характерным запахом. Гигроскопичен.
Фармакотерапевтическая группа
Противовоспалительное средство для местного применения.Фармакокинетика
При аппликации раствора диметилсульфоксида на кожу он обнаруживается в крови через 5 мин. достигая максимальной концентрации через 4-6 ч с сохранением почти неизменного уровня в течение 1,5-3 суток. Диметилсульфоксид выделяется с мочой и калом, как в неизменном виде, так и в виде диметилсульфона.
Фармакодинамика
Противовоспалительный препарат для наружного применения,
инактивирует гидроксильные радикалы, улучшает течение
метаболических процессов в очаге воспаления. Оказывает также
местноанестезирующее, анальгезирующее и противомикробное действие;
обладает умеренной фибринолитической активностью.
Оказывает также
местноанестезирующее, анальгезирующее и противомикробное действие;
обладает умеренной фибринолитической активностью.
Проникает через кожу, слизистые оболочки, оболочку микробных клеток (повышает их чувствительность к антибиотикам) и другие биологические мембраны, повышает их проницаемость для лекарственных средств.
Показания к применению
В составе комплексной терапии: заболеваний опорно-двигательного
аппарата — ревматоидный артрит, анкилозирующий спондилит (болезнь
Бехтерова), деформирующий остеоартроз (при наличии поражения
периартикулярных тканей), реактивный синовит, ограниченная
склеродермия, узловая эритема, дискоидная красная волчанка, микозы
стоп, келлоидные рубцы, тромбофлебит, алопеция, экзема,
стрептодермия. рожистое воспаление, ушибы, растяжение связок,
травматические инфильтраты, гнойные раны, ожоги, радикулит,
трофические язвы, акне, фурункулез. В кожно-пластической хирургии —
для консервирования кожных гомотрансплантатов.
Противопоказания к применению
Гиперчувствительность к диметилсульфоксиду, тяжелая печеночная и/или почечная недостаточность, стенокардия, выраженный атеросклероз, глаукома, катаракта, инсульт, кома, инфаркт миокарда, беременность, период грудного вскармливания, детский возраст до 12 лет.Беременность и лактация
Применение препарата при беременности и в период грудного вскармливания противопоказано.
Побочные действия
Аллергические реакции, контактный дерматит, эритематозные высыпания, сухость кожи, легкое жжение, зудящий дерматит, редко — бронхоспазм.
При проявлении побочных эффектов, неописанных в инструкции, следует прекратить прием препарата и сообщить об этом врачу.
Взаимодействие с лекарственными средствами
Увеличивает всасывание и усиливает действие этанола (алкоголь
тормозит выведение препарата), инсулина (при длительном применении
препарата осуществляют контроль за содержанием глюкозы в плазме
крови) и других лекарственных средств.
Способ применения и дозы
Наружно.
Диметилсульфоксид выпускается в виде концентрата, из которого перед применением готовят водный раствор необходимой концентрации для аппликации или орошений (промываний).
В водном растворе необходимой концентрации смачивают марлевые салфетки и накладывают на пораженные участки в течение 20-30 мин. Поверх салфетки накладывается полиэтиленовая пленка и хлопчатобумажная или льняная ткань. Рекомендованный период использования аппликаций 10-15 дней.
При терапии рожистого воспаления и трофических язв — в виде
30-50 % водного раствора 2-3 раза в сутки.
При экземе, стрептодермиях — компрессы с 40-90 % водным раствором.
Для местного обезболивания при болевых синдромах — 25-50 % водный раствор в виде компрессов 2-3 раза в сутки.
Для кожи лица и других высокочувствительных областей применяют 10-20-30 % водные растворы.
У детей 12-18 лет применяют 20-30 % водные растворы диметилсульфоксида.
В кожно-пластической хирургии используют повязки с 10-20 % водным раствором на пересаженные кожные ауто- и гомотрансплантаты непосредственно после операций и в последующие дни послеоперационного периода до стойкого приживления трансплантата. В качестве консервирующей среды для хранения кожных гомотрансплантатов применяют 5 % раствор диметилсульфоксида в растворе Рингера.
Менее концентрированными растворами (1-4 %) производят промывание гнойно-некротических и воспалительных очагов и полостей.
Приготовление водного раствора диметилсульфоксида:
- Содержание диметилсульфоксида 10% — Количество частей диметилсульфоксида/Количество частей воды 1/9;
- Содержание диметилсульфоксида 20% — Количество частей диметилсульфоксида/Количество частей воды 1/4;
- Содержание диметилсульфоксида 25% — Количество частей диметилсульфоксида/Количество частей воды 1/3;
- Содержание диметилсульфоксида 30% — Количество частей диметилсульфоксида/Количество частей воды 3/7;
- Содержание диметилсульфоксида 40% — Количество частей диметилсульфоксида/Количество частей воды 2/3;
- Содержание диметилсульфоксида 50% — Количество частей диметилсульфоксида/Количество частей воды 1/1;
- Содержание диметилсульфоксида 90% — Количество частей
диметилсульфоксида/Количество частей воды 9/1.

Передозировка
Возможно усиление дозозависимых побочных эффектов. В этих случаях следует прекратить применение диметилсульфоксида, промыть поврежденное место. При случайном отравлении через желудочно-кишечный тракт необходимо быстро промыть желудок, при этом следует помнить, что диметилсульфоксид быстро всасывается.
Лечение: симптоматическое.
Меры предосторожности и особые указания
Некоторые больные ощущают запах чеснока во вдыхаемом воздухе.
Перед применением препарата необходимо проводить пробу на переносимость к нему. Для этого водный раствор диметилсульфоксида необходимой концентрации наносят на кожу при помощи смоченного в нем ватного тампона; появление гиперемии и выраженного зуда свидетельствует о гиперчувствительности.
При хранении при температуре 18 °C и ниже происходит
кристаллизация диметилсульфоксида, которая не влияет на качество
препарата. Для расплавления кристаллов следует осторожно разогреть
флакон на водяной бане (температура воды не выше 60 °C).
Для расплавления кристаллов следует осторожно разогреть
флакон на водяной бане (температура воды не выше 60 °C).
Влияние на способность к вождению автотранспорта и управлению механизмами
Применение препарата в соответствии с инструкцией не влияет на способность управлять транспортными средствами, работать с движущимися механизмами.
Условия хранения
При комнатной температуре
Условия отпуска из аптек
Без рецепта
Бриллиантовый зеленый раствор 1% 10 мл
Состав
действующее вещество: бриллиантовый зеленый;
100 мл раствора содержат бриллиантового зеленого 1 г
вспомогательные вещества: этанол 60%.
Врачебная форма. Раствор для наружного применения, спиртовой 1%.
Основные физико-химические свойства: жидкость интенсивно зеленого цвета с запахом спирта.
Фармакологическая группа. Антисептические и дезинфицирующие средства. Код АТХ D08А Х.
Фармакологические свойства.
Фармакология.
Антисептическое средство для наружного и местного применения. Оказывает антимикробное действие. Препарат активен в отношении грамположительных бактерий.
Фармакокинетика.
Препарат местного действия. Данных о всасывании в кровь и участие в метаболических процессах организма не обнаружено.
Клинические характеристики.
Показания. Гнойно-воспалительные процессы кожи (пиодермия, фурункулез, карбункулез, блефарит) легкой формы, а также обработка операционного поля, кожных покровов после операций и травм.
Противопоказания. Повышенная чувствительность к компонентам препарата.
Особые меры безопасности. Не допускать попадания препарата в глаза. Не следует нарушать правила применения лекарственного средства, это может повредить здоровью.
Не следует нарушать правила применения лекарственного средства, это может повредить здоровью.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий. При одновременном применении с препаратами для наружного применения, которые содержат органические соединения, может денатурировать белки, образовывать новые соединения. Не совместим с дезинфицирующими препаратами, содержащими активный йод, хлор, щелочи (в том числе раствор аммиака). При одновременном применении любых других лекарственных средств следует сообщить врачу.
Особенности применения. Не следует допускать попадания раствора на слизистые оболочки, поскольку спирт, содержащийся в препарате, может вызвать ожоги, сильное раздражение. Активность препарата существенно уменьшается в присутствии сыворотки крови.
Применение в период беременности или кормления грудью. Применяют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами. Не влияет.
Не влияет.
Способ применения и дозы. Наносят на поверхность кожи, при нарушении ее целостности охватывают окружающие здоровые ткани. При заболеваниях глаз смазывают края век.
Дети.Применяют.
Передозировки. Не наблюдалось.
Побочные реакции. Аллергические реакции (зуд, крапивница). При попадании раствора на слизистую оболочку глаза возникает жжение, слезотечение, могут появиться ожоги.
В случае появления любых нежелательных явлений необходимо обратиться к врачу!
Срок годности. 2 года. Препарат нельзя применять после окончания срока годности, указанного на упаковке.
Условия хранения. Хранить при температуре не выше 25 ° С, вдали от огня. Хранить в недоступном для детей месте.
Упаковка. По 10 мл во флаконах, в пачке или без пачки; по 20 мл во флаконах-капельницах, в пачке или без пачки.
Категория отпуска. Без рецепта.
Без рецепта.
Производитель / заявитель.
ООО «Тернофарм».
Местонахождение производителя и адрес места осуществления его деятельности.
ООО «Тернофарм»
Украина, 46010, г.. Тернополь, ул. Фабричная, 4
Тел. / Факс: (0352) 521-444, http://www.ternopharm.com.ua.
Дата последнего посещения. 04.10.18
Растворитель раствор насыщенный — Справочник химика 21
Разбавленные растворы. Понижение давления насыщенного пара растворителя. Давление насыщенного пара является весьма важным свойством растворов, с которым связан и ряд других свойств. [c.298] Различают растворы насыщенные, ненасыщенные и пересыщенные. Раствор, содержащий максимальное количество вещества, которое может раствориться в данном количестве растворителя при определенной температуре (с образованием устойчивого раствора), называют насыщенным. [c.87]
[c.87]
Очищенный масляный раствор отделяется от растворителя перегонкой. Насыщенный адсорбент подвергается десорбции с выделением от него полярных многоядерных ароматических углеводородов и гетероциклических соединений. [c.151]
Выделение бутадиена водно-аммиачным раствором уксуснокислой медн основано на способности бутадиена образовывать с солями одновалентной меди комплексы, разлагающиеся на исходные составные части прн повышении температуры до 80°. Основными аппаратами установки являются абсорбер и отпарная колонна. При контактировании с раствором бутадиен абсорбируется в нем, в то время как большая часть бутана и бутадиенов выводится из системы. Растворитель контактируется с углеводородной фракцией последовательно в несколько ступеней, представляющих собой главным образом турбосмесители и сепараторы. Углеводородная фракция после извлечения из нее бутадиена промывается водой и поступает на рециркуляцию илп на установку алкилпрования. Раствор, насыщенный бутадиеном, подается в де-сорбционную колонну, где из него выделяется углеводородная часть, которую отмывают в скруббере водой от увлеченного растворителя. Из скруббера бутадиеновый поток поступает в колонну редистилляции, где освобождается от примесей. Абсорбция проводится при 37°, десорбция при 79°. Этот метод дорогой и применяется при малых содержаниях бутадиена в газах. [c.72]
Раствор, насыщенный бутадиеном, подается в де-сорбционную колонну, где из него выделяется углеводородная часть, которую отмывают в скруббере водой от увлеченного растворителя. Из скруббера бутадиеновый поток поступает в колонну редистилляции, где освобождается от примесей. Абсорбция проводится при 37°, десорбция при 79°. Этот метод дорогой и применяется при малых содержаниях бутадиена в газах. [c.72]
При введении достаточного количества растворенного вещества в двухслойную систему получаются два равновесных насыщенных раствора. Насыщение обоих слоев наступает одновременно, так как равные между собой химические потенциалы растворенного вещества в обоих растворителях одновременно делаются равными химическому потенциалу чистого растворяемого вещества. [c.217]
В колбу аппарата Сокслета помещают безводную уксусную кислоту, к которой добавлено небольшое количество уксусного ангидрида. После заполнения экстрактора медной стружкой в него впускают воздух и кипятят растворитель.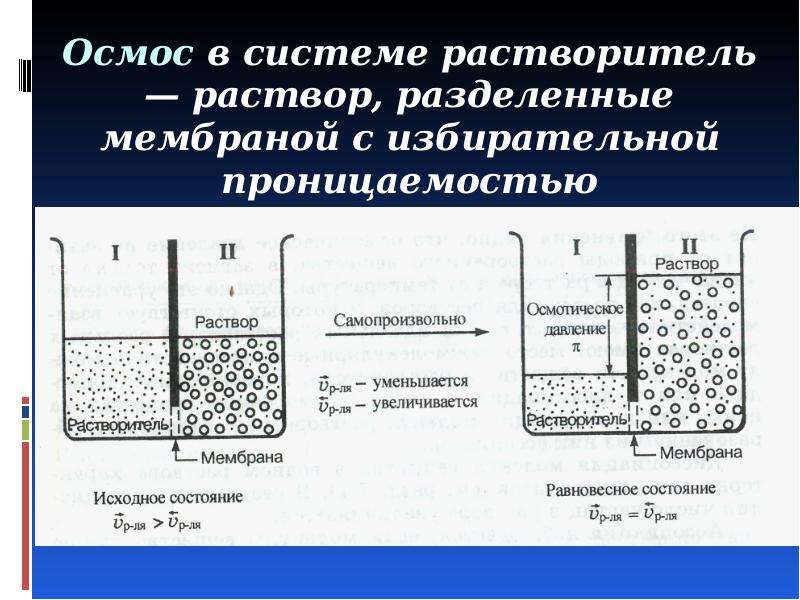 Через 1—2 ч образуется раствор, насыщенный ацетатом меди. Полученный [c.556]
Через 1—2 ч образуется раствор, насыщенный ацетатом меди. Полученный [c.556]
Кристаллизация может происходить не только при охлаждении горячего насыщенного раствора, она наблюдается также при испарении части растворителя из насыщенного рас т в о-, ра при постоянной температуре. Упаривание в данном случае проводят не при нагревании, но, что особенно ценно при работе с низкоплавкими и неустойчивыми соединениями, при нормальной температуре или при охлаждении. Необходимое условие получения чистых кристаллов — непрерывное перемешивание в процессе испарения. Особенно удобен для этих целей ротационный испаритель. [c.119]
Растворителя с насыщением С….. Сырого рафината Я. ……… Сырого экстракта Е. ……… Рафината и экстракта в сумме Н- — Е. . 253.2 53,2 300 353.2 200 53,7 246,3 300,0 Количество исходного раствора 100 кг, в том числе ацетона 50 кг. воды 50 кг [c.124]
Для бесконечно большого числа ступеней концентрации в потоках рафината перед той ступенью, на которую поступает исходный раствор, и за ней—такие же, как и в исходном растворе.
 Предположим еще, что исходный раствор насыщен растворителем, и запишем [c.171]
Предположим еще, что исходный раствор насыщен растворителем, и запишем [c.171]Определение концентрации маточного раствора и давления в аппарате. Концентрация маточного раствора (насыщенного раствора при 15° С) аа = 0,248. Для этой концентрации температурная депрессия составляет 3°С. Температура насыщения паров растворителя составляет [c.522]
Эти взгляды могут быть распространены и на растворы ВМС, а также многокомпонентные нефтяные системы. Молекулы растворенного соединения удерживают вокруг себя определенное для данных условий число молекул растворителя. Раствор занимает объем, равный сумме объемов сольватированных молекул и объема не связанного в сольватных слоях растворителя (неустойчивые ассоциаты и комплексы). В насыщенном растворе относительно свободных или н связанных в сольватные оболочки молекул не должно быть. Насыщенный раствор в связи с этим можно рас- [c.92]
Когда раствор насыщен или находится в метастабильной области, границы перекрытых сольватных оболочек условны, так как молекулы растворителя находятся в суммарном поле всех растворенных молекул в том смысле, что поля растворенных молекул перекрыты и образуют одно сплошное поле. Состояние насыщенного и пересыщающегося раствора можно сравнить с гелеобразным состоянием коллоидных систем, однако в отличие от них молекулы растворителя в сольватных оболочках значительно подвижнее (время жизни ассоциатов и комплексов существенно меньше) и они могут переходить из поля одной растворенной молекулы в поле другой. [c.93]
Состояние насыщенного и пересыщающегося раствора можно сравнить с гелеобразным состоянием коллоидных систем, однако в отличие от них молекулы растворителя в сольватных оболочках значительно подвижнее (время жизни ассоциатов и комплексов существенно меньше) и они могут переходить из поля одной растворенной молекулы в поле другой. [c.93]
Компонентами, участвующими в реакции, могут быть ионы окислителя, восстановителя, водорода и др., молекулы растворителя (например, воды), твердая фаза (металл, оксид металла или малорастворимый электролит) и газообразные вещества (например, Нг, О2, С1г и пр.). При этом в уравнении (33) не фигурируют те компоненты, активность которых постоянна или равна единице. К таким компонентам относятся твердая фаза, газообразное вещество, если раствор насыщен им при давлении 1 атм, а также растворитель вследствие большой его концентрации и тем самым малых изменений его активности в процессе реакции. [c.102]
Теоретическое пояснение. Если в жидкости (растворителе) растворить небольшое количество нелетучего вещества, то молярная доля растворителя в растворе (хд) понизится в соответствии с этим понизится и давление насыщенного пара растворителя над раствором (насыщенным называется пар, находящийся в равновесии с жидкостью или твердым телом). Согласно закону Рауля давление насыщенного пара растворителя над разбавленным раствором [c.24]
Если в жидкости (растворителе) растворить небольшое количество нелетучего вещества, то молярная доля растворителя в растворе (хд) понизится в соответствии с этим понизится и давление насыщенного пара растворителя над раствором (насыщенным называется пар, находящийся в равновесии с жидкостью или твердым телом). Согласно закону Рауля давление насыщенного пара растворителя над разбавленным раствором [c.24]
При нагревании охлажденных систем все явления повторяются, но только в обратном порядке. Смесь, которая будет плавиться при какой-то менее низкой температуре по сравнению со смесями иных концентраций этой системы называется эвтектической или эвтектикой. Таким образом, термические явления при охлаждении и нагревании эвтектических смесей протекают так же, как и у химических веществ, несмотря на то, что последние представляют собой совершенно однородную систему, в то время как затвердевшая эвтектика есть конгломерат, составные части которого видны под микроскопом и могут быть отделены друг от друга или растворителями, или механическим путем. Эвтектика есть состав из нескольких компонентов, который имеет определенную характерную структуру и дает при плавлении раствор, насыщенный относительно всех компонентов, входящих в его состав. [c.229]
Эвтектика есть состав из нескольких компонентов, который имеет определенную характерную структуру и дает при плавлении раствор, насыщенный относительно всех компонентов, входящих в его состав. [c.229]
Здесь N — мольная доля растворителя в насыщенном жидком растворе. Отсюда [c.135]
Количественно способность различных веществ растворяться определяется растворимостью. Растворимостью называется число граммов вещества, которое, будучи растворено при данной температуре в 100 г растворителя, дает насыщенный раствор. О растворимости отдельных твердых веществ в 100 г воды при 20° С можно судить по данным табл. 9. [c.126]
Фазой называется гомогенная часть системы с определенными химическими и физическими свойствами фаза отделена от других частей (фаз) отграничивающими поверхностями. Например, насыщенный раствор соли состоит из трех фаз пара растворителя, раствора и кристаллов соли. В системе может быть несколько твердых фаз. Так, если раствор насыщен в отношении двух разных веществ, то кристаллы одного вещества образуют одну твердую фазу, а кристаллы другого — вторую твердую фазу. [c.158]
Так, если раствор насыщен в отношении двух разных веществ, то кристаллы одного вещества образуют одну твердую фазу, а кристаллы другого — вторую твердую фазу. [c.158]
В отличие от чистого растворителя раствор не отвердевает целиком при постоянной температуре полная кристаллизация раствора происходит в некотором интервале температур. Поэтому температурой замерзания раствора считают ту температуру, при которой в процессе охлаждения начинают выделяться первые кристаллы чистого растворителя. Этой температуре также отвечает равенство давлений насыщенного пара над жидким раствором и над кристаллами растворителя. Следовательно, температурами замерзания растворов разных составов будут точки Л, А». Из рис. 72 можно заключить, что растворы должны замерзать при более низких температурах, чем чистый растворитель. Это явление еще в 1755 г. наблюдал М. В. Ломоносов. Оно подтверждается термодинамическим анализом (см. гл. XV, 6). [c.206]
Растворимость вещества 8 Масса вещества в 100 г растворителя в насыщенном растворе г сбО С — 9) [c.
 18]
18]Раствор- это однородная система, в которой молекулы или ионы растворенного вещества распределяются между молекулами растворителя. Растворы бывают насыщенными и ненасыщенными. Н а -с ы щ е н н ы м называется раствор, в котором при определенной температуре вещество больше не растворяется. Ненасыщенным называется раствор, в котором при определенной температуре вещество еще может растворяться. [c.26]
Растворимость выражается количеством вещества, способного растворяться в определенном весовом или объемном количестве растворителя, образуя насыщенный раствор. Чаще всего растворимость выражают количеством граммов вещества, которое может раствориться в 100 г растворителя при определенной температуре, образуя насыщенный раствор. [c.26]
Таким образом, основой структуры вещества в твердом состоянии является кристалл. На его размеры сильно влияют условия кристаллизации, которую проводят обычно из растворов. Желая получить мелкие кристаллы, быстро охлаждают раствор, насыщенный при высокой температуре. Наоборот, желая вызвать образование крупных кристаллов, оставляют раствор стоять при обычной температуре, чтобы кристаллизация медленно протекала по мере испарения растворителя. [c.377]
Наоборот, желая вызвать образование крупных кристаллов, оставляют раствор стоять при обычной температуре, чтобы кристаллизация медленно протекала по мере испарения растворителя. [c.377]
Растворимость гидроксидов и солей. Растворимость вещества определяют его равновесным содержанием в единице объема или массы растворителя или насыщенного раствора. Чаще растворимость выражают в массовых долях. Форма записи процесса растворения может отражать либо сам факт перехода в раствор [c.133]
Если данное вещество в двух несмешивающихся растворителях растворяется в относительно небольших количествах, то отношение концентраций насыщенных растворов в обоих растворителях Са и Сб) при данной температуре есть величина постоянная, называемая коэффициентом распределения. [c.65]
В то же время при 20° С в 100 г воды максимально может раствориться 0,21 г гипса. Это раствор насыщенный. Но он одновременно является разбавленным, так как количество растворенного гипса по сравнению с количеством растворителя очень мало. [c.110]
[c.110]
Приборы и реактивы. Прибор для получения хлороводорода (рис. 40). Стеклянные палочки. Сетка асбе-стнрованная. Кристаллизатор или чашка фарфоровая. Стакан химический (вместимостью 100 мл). Электрическая плитка. Диоксид марганца. Хлорид натрия. Бромид натрия. Иодид калия. Дихромат калия. Соль Мора. Перхлорат калия. Перманганат калия. Хлорат калия. Магний (порошок). А люминий (порошок). Цинк (порошок). Индикаторы лакмусовая бумажка, лакмус синий. Органический растворитель. Растворы хлорной воды бромной воды йодной воды сероводородной воды хлорида натрия (0,5 и.) бромида натрия (0,5 н.) иодида калия (0,1 н.) нитрата серебра (0,1 н.) хлорида хлората калия (насыщенный) перхлорат калия (0,5 и.) дихромата калия (0,5 н.) перманганата калия (0,5 н.) тиосульфата натрия (0,5 н,) едкого натра (2 н.) хлороводородной кислоты (плотность 1,19 г/см ) серной кислоты (плотность 1,84 г/см 70%-ной) фосфорной кислоты (концент-рироввиная). [c.132]
Температуры кипения растворов. Любая жидкость кипит ири температуре, при которой давление ее насыщенного пара достигает значения внешнего давления. Температура, при которой давление насыщенного пара становится равным нормальному давлению, т. е. 101,3 кПа, называется нормальной температурой кипения. Согласно первому (тонометрическому) закону Рауля (см. 6) давление насыщенного пара растворителя над раствором меньше давления пара над чистым растворителем при той же температуре, причем тем меньше, чем больше концентрация растворенного вещества (см. рис. 17). Это значит, что если растворенное вещество нелетуче, то ири температуре кипения чистого растворителя давление насыщенного пара над раствором не достщ ает нормального давления и, следовательно, раствор при этой температуре не кипит. Давление насыщенного пара над раствором нелетучего вещества достигает нормального давления при более высокой температуре и, следовательно, температура кипения та ого раствора вь ше температуры кипения чистого растворителя. Очевидно, что температура кипения раствора нелетучего вещества, как это видрю из рис.
Любая жидкость кипит ири температуре, при которой давление ее насыщенного пара достигает значения внешнего давления. Температура, при которой давление насыщенного пара становится равным нормальному давлению, т. е. 101,3 кПа, называется нормальной температурой кипения. Согласно первому (тонометрическому) закону Рауля (см. 6) давление насыщенного пара растворителя над раствором меньше давления пара над чистым растворителем при той же температуре, причем тем меньше, чем больше концентрация растворенного вещества (см. рис. 17). Это значит, что если растворенное вещество нелетуче, то ири температуре кипения чистого растворителя давление насыщенного пара над раствором не достщ ает нормального давления и, следовательно, раствор при этой температуре не кипит. Давление насыщенного пара над раствором нелетучего вещества достигает нормального давления при более высокой температуре и, следовательно, температура кипения та ого раствора вь ше температуры кипения чистого растворителя. Очевидно, что температура кипения раствора нелетучего вещества, как это видрю из рис. 17, тем выше, чем больше концентрация этого вещества в растворе. Установлено, что повышение температуры кипения А ,,п равно разности между температурами кипения раствора и чистого растворителя и пропорционально моляльной концентрации нелетучего вещества [c.163]
17, тем выше, чем больше концентрация этого вещества в растворе. Установлено, что повышение температуры кипения А ,,п равно разности между температурами кипения раствора и чистого растворителя и пропорционально моляльной концентрации нелетучего вещества [c.163]
Может возникнуть мысль, что насыщенный раствор одной какой-либо соли представляет собой малопригодную среду для растворения другого вида соли или сахара. Мы представляем себе насыщенный раствор соли, как раствор, в котором отсутствует свободная вода, так как все наличие воды идет на гидрацию ионов соли. Поэтому мы предполагаем, что в растворе нет воды, требуемой для растворения другой соли, или такого менее гидрофильного вещества, как сахар. Тем не менее фактически имеется возможность растворять в насыщенном растворе хлористого натрия как другой вид соли, так и сахар. Например, насыщенный водный раствор хлористого натрия (75%-ной относительной влажности) способен полностью удалить из искусственного щелка глюкозу, которой она была пропитана. Таким образом, мы принуждены заключить, что гидратизированные ионы соли обладают способностью сами действовать в качестве молекул растворителя. Раствор той же относительной влажности, состоящий из детергента и растворителя стоддард , в состоянии удалить при тех. же условиях лишь небольшую часть глюкозы (см. ссылку 156а). [c.188]
Таким образом, мы принуждены заключить, что гидратизированные ионы соли обладают способностью сами действовать в качестве молекул растворителя. Раствор той же относительной влажности, состоящий из детергента и растворителя стоддард , в состоянии удалить при тех. же условиях лишь небольшую часть глюкозы (см. ссылку 156а). [c.188]
Фторкаучуки. Фторсодержащие каучуки (СКФ или, как их еще называют, фторорганические каучуки) являются продуктами сополимеризации фторированных углеводородов — фторолефинов или перфторвиниловых эфиров. Промышленность выпускает СКФ-26 (вайтон), СКФ-32 (kel-F). Все они являются эластомерами белого или светло-кремового цвета. Фторкаучуки хорошо хранятся, не имеют запаха и при умеренных температурах физиологически инертны. Лишь при температурах выше 200 °С начинают выделять токсичные продукты разложения. Фторкаучуки — полностью насыщенные полимеры, содержащие большое количество полярных атомов фтора, и поэтому характеризуются исключительно высокой стойкостью к воздействию сильных окислителей, синтетических и минеральных масел, топлив и даже некоторых растворителей.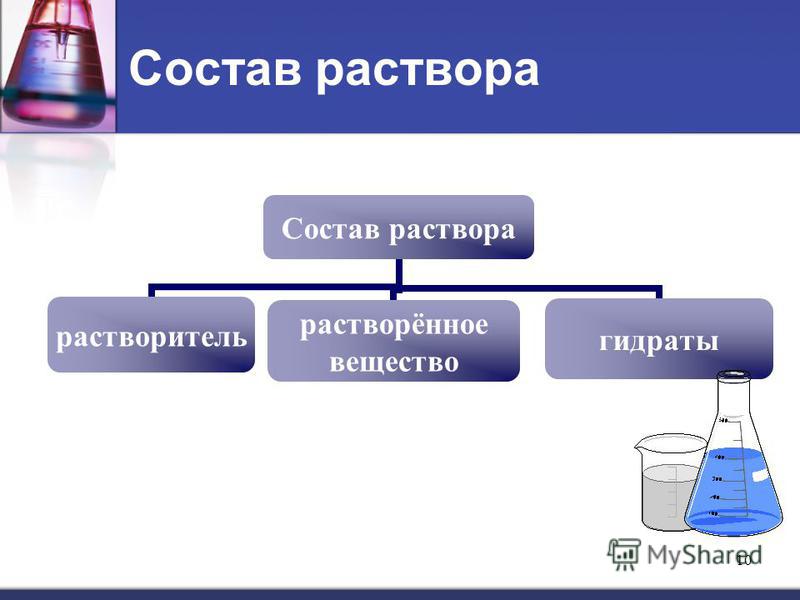 Растворяются в сложных кетонах. Вулканизацию ведут в основном перекисями в две стадии в пресс-форме при температуре 130-130 °С (30-50 мин) и в воздушной среде при 180-260 С (24 ч). [c.20]
Растворяются в сложных кетонах. Вулканизацию ведут в основном перекисями в две стадии в пресс-форме при температуре 130-130 °С (30-50 мин) и в воздушной среде при 180-260 С (24 ч). [c.20]
Аналогичные результаты получаются при воздействии растворителя на насыщенные растворы. Таким образом, хлорируя технически чистые окислы кобальта или никеля, либо растворяя в НС1 их гидраты, а затем обрабатывая высушенные хлориды или их сильноконцентрированные растворы этилацетатом, насыщенным НС1, мы получаем хлорид никеля, совершенно свободный от кобальта, и после отгонки этилацетата — хлорид кобальта с примесями хлоридов железа, меди, от которых легко освободиться осаждением меди сероводородом, а железа — в виде гидроокисей. [c.577]
Стакан (или бюкс-) с оставщейся солью взвещивают и по разности конечного и начального результатов взвешивания приблизительно находят массу растворенной соли и ее растворимость (в г/л). По полученному значению находят степень разбавления насыщенного раствора соли перед титрованием. С помощью пипетки переносят 5 мл насыщенного раствора соли в мерную колбу и разбавляют его водой так, чтобы титр образовавшегося раствора составлял 0,0025 г/см для K I и 0,0020 г/см для Na l. Мерную колбу выбирают (по емкости), исходя из объема воды, необходимого для получения разбавленного раствора. Например, если в 20 мл смешанного растворителя растворилось около 2 г соли, то в 5 мл этого раствора содержится, около 0,5 г соли, и для получения раствора указанного титра требуется добавить воды до 200,мл. [c.135]
С помощью пипетки переносят 5 мл насыщенного раствора соли в мерную колбу и разбавляют его водой так, чтобы титр образовавшегося раствора составлял 0,0025 г/см для K I и 0,0020 г/см для Na l. Мерную колбу выбирают (по емкости), исходя из объема воды, необходимого для получения разбавленного раствора. Например, если в 20 мл смешанного растворителя растворилось около 2 г соли, то в 5 мл этого раствора содержится, около 0,5 г соли, и для получения раствора указанного титра требуется добавить воды до 200,мл. [c.135]
Если спиртовой и водный растворы соли находятся в равновесии с твердой солью, то они находятся в равновесии и между собой. Растворенная соль в этих растворах имеет одинаковую активность. Перенос вещества из насыщенного раствора в одном растворителе в насыщенный раствор в другом растворителе не сопровождается работой, если они насыщены по отношению к твердой фазе одного состава. (Если растворы находятся в равновесии с разными кристаллосольватами, то работа переноса уже не равна нулю. ) Для насыщенных растворов абсолютная активность растворенного вещества при данной температуре является величиной постоянной а = onst, Яц = = Янь- Отсюда следует, что концентрационная активность а насыщенного раствора соли в неводном растворителе, умноженная на 7 том же растворителе, равна концентрационной активности в растворителе, выбранном в качестве стандартного, т. е. в воде а в7о = al, откуда [c.65]
) Для насыщенных растворов абсолютная активность растворенного вещества при данной температуре является величиной постоянной а = onst, Яц = = Янь- Отсюда следует, что концентрационная активность а насыщенного раствора соли в неводном растворителе, умноженная на 7 том же растворителе, равна концентрационной активности в растворителе, выбранном в качестве стандартного, т. е. в воде а в7о = al, откуда [c.65]
Зависимость растворимости от температуры. Растворимость — это содержание данного компонента в насыщенном растворе при постоянных внешних условиях. Растворимость вещества в жидкости зависит от различных факторов (температуры, давления, природы растворяемого вещества и растворителя и т. д.). В соответствии с правилом фаз Гиббса при р = onst система чистый компонент— раствор условно моновариантна, т. е. X =f T), где X — концентрация (в молярных долях) раствора, насыщенного i-M компонентом. Если при постоянном давлении изменить температуру на aT, то за счет изменения концентрации раствора на dA вновь установится равновесие. Это означает, что dp,i = d(Ai, т. е. [c.124]
Это означает, что dp,i = d(Ai, т. е. [c.124]
Я) Образование ацетилена из элементов идет лишь выше 2000 °С и сопровождается поглощением тепла (54 ккал/моль). Будучи сильно эндотермичным соединением, ацетилен способен разлагаться со взрывом. В газообразном состоянии такой распад при обычных условиях не происходит, но под повышенным давлением, и особенно в жидком или твердом состоянии, может произойти от самых ничтожных воздействий (сотрясения и т. п.). Растворимость ацетилена в воде (1 1 по объему при обычных условиях) значительно меньше, чем в различных органических растворителях. Охлаждением насыщенного водного раствора может быть получен кристаллогидрат С2Н2 6Н2О. [c.534]
В многокомпонентних расслаивающихся растворах число равновесных фаз может быгь больше двух. В том случае, когда растворенное вещество находится в другом агрегатном состоянии, чем растворитель (раствор твердого вешества или газа в жидкости, газа в Твердом веществе и др. ), область суще-стьования растворов простирается от чистого растворителя до состава, отвечающего насыщенному раствору. [c.226]
), область суще-стьования растворов простирается от чистого растворителя до состава, отвечающего насыщенному раствору. [c.226]
Набухание далеко не всегда кончается растворением полимера. Очень часто после достижения определенной степени набухания процесс прекращается из-за того, что высокомолекулярное вещество ограниченно растворяется в данном растворителе. Вследствие этого в конце процесса набухания образуется две фазы — насыщенный раствор полимера в растворителе и насыщенный раствор растворителя в полимере (студень). Такое ограниченное набухание имеет много общего с ограниченным растворением жидкостей. Примерами набухания, обусловленного ограниченным растворением, является набухание поливинилхлорида в ацетоне и полихлоронрена в бензоле. [c.152]
Для температуры 7 на диаграмме растворимости двухкомпонентной системы в точках Л/ и /С имеются растворы, насыщенные соответственно веществами А (льдом) и В (растворенным веществом). Над этими растворами давление пара летучего компонента (воды) д-, г, и Р , а над чистым летучим компонентом (льдом) — Ра, Г] При температуре весь растворитель (вода) находится [c. 94]
94]
Во втором случае испарение растворителя из раствора, насыщенного при температуре л приводит к пересыщению Ас оп = = — Со, лг ,. Нагрев насыщенного раствора от до обуславливает создание пересыщения на величину ДСнагр = Со, ыъ — о, [c.100]
Выщелачивание — это экстракция жидким растворителем растворимого твердого компонента из системы, состоящей из двух или большего числа твердых фаз. В старину выщелачиванием называли процесс получения щелоков , например поташного щелока — при обработке водой древесной золы из нее извлекали растворимый поташ (карбонат калия). Термин выщелачивание применяют к таким процессам экстракции, в которых водой или водными растворами кислот, щелочей, солей извлекают содержащиеся в твердых смесях неорганические вещества. Примерами промышленных процессов выщелачивания являются извлечение хлорида калия из сильвинита, глинозема из нефелинового спека, хроматов из хроматного спека, процессы кислотного извлечения компонентов полиминеральных руд и многие другие.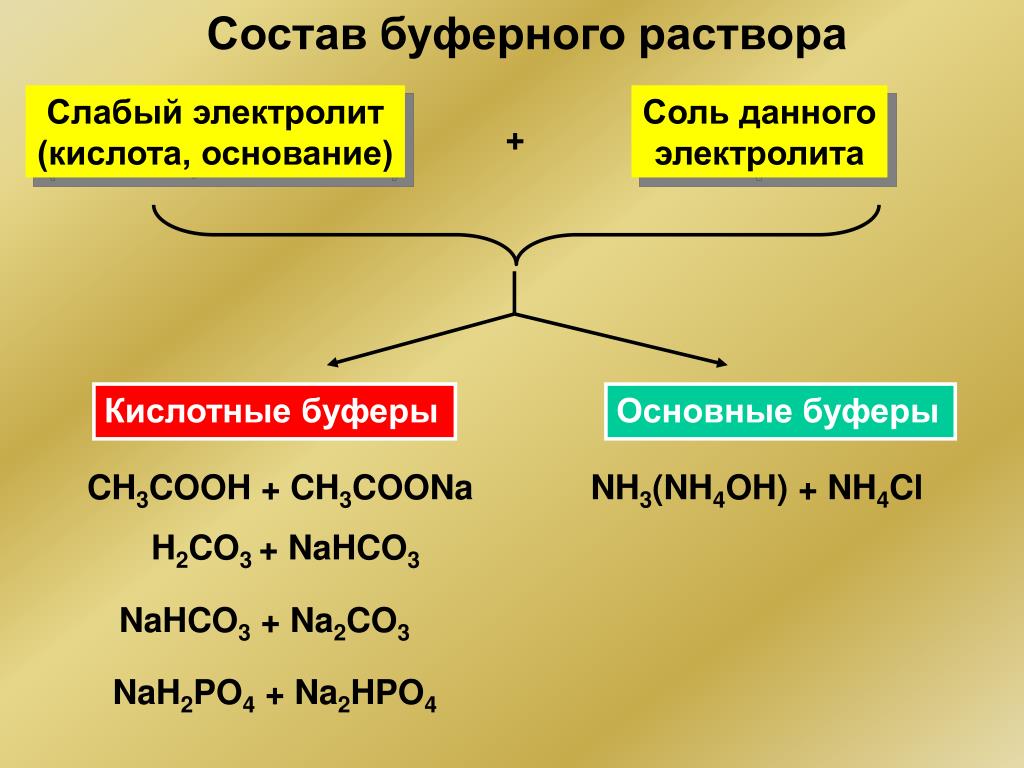 Если обрабатываемая твердая система содержит несколько растворимых компонентов, а в раствор требуется извлечь лишь один из них, выщелачивание ведут раствором, насыщенным всеми компонентами, кроме подлежащего извлечению. Так, выщелачивание КС1 из сильвинита (КС1 + Na l) осуществляют водным раствором, насыщенным — Na l, но не насыщенным КС1. [c.223]
Если обрабатываемая твердая система содержит несколько растворимых компонентов, а в раствор требуется извлечь лишь один из них, выщелачивание ведут раствором, насыщенным всеми компонентами, кроме подлежащего извлечению. Так, выщелачивание КС1 из сильвинита (КС1 + Na l) осуществляют водным раствором, насыщенным — Na l, но не насыщенным КС1. [c.223]
В значительно более частом случае ограниченной взаимной растворимости веществ растворителем служит тот компонент, структуру которого сохраняет раствор. Так, при 20° С в системе НгО — Na l при содержании менее 26,4% Na l (это концентрация насыщенного раствора) растворитель — вода в системе Н2О—(СгН5)гО, содержащей (при 20° С) меньше 6,89% эфира, растворитель — вода, а при его содержании больше 98,64% — эфир (между указанными концентрациями эфира система представляет собой двухслойную жидкость верхний слой — раствор воды в эфире и нижний — раствор эфира в воде) в системе Си—Zn при 600° С в меди как растворителе растворяется до 37% цинка и твердый раствор имеет структуру меди — гранецентрированную кубическую решетку, и одновременно в цинке как растворителе растворяется до 11 % меди с образованием твердого раствора с кристаллической решеткой цинка — гексагональной решеткой. Формально в подобных системах с ограниченной растворимостью растворитель можно определить как тот компонент, при прибавлении которого не может образоваться насыщенный раствор. В этом легко убедиться, рассматривая вышеприведенные примеры. [c.230]
Формально в подобных системах с ограниченной растворимостью растворитель можно определить как тот компонент, при прибавлении которого не может образоваться насыщенный раствор. В этом легко убедиться, рассматривая вышеприведенные примеры. [c.230]
Понижение давления пара над раствором влияет на температуры замерзания и кипения. На рис. 115 представлены температурные зависимости давления иара чистого растворителя п двух растворов различной концентрации. Кривая ас представляет собой гемпературную зависимость давления насыщенного пара твердого растворителя, а кривая оЬ — аналогичную зависимость для чистого жидкого растворителя. Кривые о Ь и о»Ь» отражают температурную зависимость давления пара растворителя над растворами двух различных концентраций, причем концентрация второго раствора выше концентрации первого. Точка о, в которой пересекаются кривые давления пара твердого и жидкого растворителей, и в которой, следовательно, эти давления равны, является точкой плавления (замерзания) чистого растворителя. Соответственно точки о, о» — точки замерзания растворителя в растворах I и II, если из растворов кристаллизуется чистый растворитель. Точки Ь, Ь, Ь» соответствуют температурам кипения растворителя, раствора I и раствора II, поскольку при этих температурах достигается давление пара растворителя, равное внешнему (атмосферному) давлению. Как следует из рис. 115, растворы замерзают при более низкой темпера- [c.248]
Соответственно точки о, о» — точки замерзания растворителя в растворах I и II, если из растворов кристаллизуется чистый растворитель. Точки Ь, Ь, Ь» соответствуют температурам кипения растворителя, раствора I и раствора II, поскольку при этих температурах достигается давление пара растворителя, равное внешнему (атмосферному) давлению. Как следует из рис. 115, растворы замерзают при более низкой темпера- [c.248]
Понятие раствора.
Коллоидная химия
Растворы.
Растворами называют однородные системы переменного состава. Химический состав и физические свойства одного раствора во всех частях его объёма одинаковы.
В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Часто для определения раствора используют понятия гомогенной и системы.
В этом случае, раствором называется гомогенная система, состоящая из двух или более компонентов.
Гомогенные и гетерогенные системы
Гомогенная система (от греч. όμός — равный, одинаковый; γένω — рождать) — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система (от греч. έτερος — разный; γένω — рождать) — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела.
Растворы могут существовать в трёх агрегатных состояниях – твёрдом, жидком и газообразном (парообразном).
Примерами твёрдых растворов могут служить некоторые сплавы металлов, например сплав золота и меди, газообразных – воздух.
Наиболее важный вид растворов – жидкие растворы.
Растворы имеют чрезвычайно важное значение в жизни человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.).
Растворители
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода),
то растворителем считается компонент, находящийся в большем количестве.
Истинные и коллоидные растворы
В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности). Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на:
1. Истинные растворы (размер частиц меньше 1 мкм) и
2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Они гетерогенны,
так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой).
Растворы высокомолекулярных соединений: белков, полисахаридов, каучука обладают свойствами как истинных, так и коллоидных растворов и выделяются в особую группу.
Растворы, механические смеси и химические соединения
Однородность растворов делает их очень сходными с химическими соединениями.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов.
Раствор это не одно химическое соединение, а как минимум два смешанных соединения. В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям.
Механическая смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонентов). В смеси исходные вещества включены неизменными. При смешивании не возникает никакое новое вещество.
От механических смесей растворы резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Процесс растворения
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.
Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.
Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением, а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов, если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем больше концентрация раствора.
А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент,
когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие,
при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.
Тогда устанавливается динамическое равновесие,
при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
- Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым.
- Если растворяется менее 1 г вещества – малорастворимым.
- Если в раствор переходит менее 0,01 г вещества, то такое вещество называют практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества,
состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак),
а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Однако, обычно вещества,
состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак),
а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.
Буровые растворы: состав, свойства, способы приготовления
При работе нефтяной или газовой скважины, ее разработке используется специальный буровой раствор, приготавливаемый непосредственно перед добычей полезных ископаемых. Его использование позволяет решить большой спектр задач, начиная от фильтрации и очистки забоя и стволового пространства и заканчивая основными требованиями техники безопасности, поэтому применение такого раствора является необходимым процессом в ходе разработки любого месторождения. Современные растворы могут иметь разный состав, вязкость, вес и другие характеристики, и приготовление осуществляется с учетом особенностей залежей, выбранных технологий, финансовых аспектов и других факторов.
Современные растворы могут иметь разный состав, вязкость, вес и другие характеристики, и приготовление осуществляется с учетом особенностей залежей, выбранных технологий, финансовых аспектов и других факторов.
Что такое буровой раствор?
Буровым раствором называют сложную дисперсионную систему жидкостей эмульсионного, аэрационного и суспензионного типа, которые служат для промывки стволов в ходе бурения скважин. Циркулируя внутри, раствор чистит стенки от наслоений, вымывает остатки пробуренных пород, выводя их на поверхность, стимулирует разрушение слоев инструментом, позволяет провести качественное вскрытие горизонта и решить массу иных задач.
Как правило, при бурении используются составы на основе воды и углеводородных частиц (раствор битума и известняка, эмульсии инвертного типа). Для бурения в отложениях хемогенного вида обычно используется приготовление буровых растворов на основе соленасыщенных глинистых элементов, гидрогелей, при высоком риске обвалов применяют растворы-ингибиторы, а в случае повышенной температуры создаются термостойкие составы на глинистой основе. Если же разработка осуществляется на месторождениях с повышенными показателями давления, то необходимо использовать растворы утяжеленного типа.
Если же разработка осуществляется на месторождениях с повышенными показателями давления, то необходимо использовать растворы утяжеленного типа.
Свойства буровых растворов
Продуктивность работы с использованием раствора зависит от качества последнего. Особенно важными являются такие свойства, как плотность, водоотдача, вязкость, напряжение сдвига. Плотность измеряется при помощи ареометра, ее показатель варьируется в пределах 1000-2500 кг на кубометр, а вязкость условного типа определяется временем, за которое раствор в определенном объеме протекает из классической воронки. Существует также эффективная вязкость, которую измеряют вискозиметром, и она отображает соотношение напряжений в общем потоке и скоростного градиента.
Что касается напряжения сдвига, то его также измеряют вискозиметром; стандартное значение колеблется в пределах 0-20 Па. Для измерения водоотдачи нужно знать объем фильтрата, который выделяется через очистное оборудование при перепаде давления за полчаса на 100 и более кПа.
Чтобы обеспечить максимальную продуктивность бурения, свойства растворов контролируют посредством ввода специальных реагентов и материалов для улучшения качества. Так, при необходимости уменьшения водоотдачи буровой раствор могут обработать реагентами на углещелочной основе, сульфитно-спиртовым составом, целлюлозными добавками, крахмалом модифицированного типа. Реологические качества достигаются посредством ввода в буровые растворы понизителей вязкости: к ним относится, например, нитролигнин, полифенолы, фосфат и другие вещества.
Предотвращение проявлений воды, нефти и газа при повышенном давлении осуществляется посредством увеличения плотности состава: для этого в раствор вводят утяжелитель (бармит, мел, гематит). В состав также может быть добавлен пенообразователь или произведено аэрирование. Антифрикционные качества растворов улучшаются посредством добавления смазок (графит, нефть, гудрон и пр.), а для сохранения нужных свойств при высоких температурах во время эксплуатации буровые растворы обогащают хроматами кальция, натрия, антиоксидантами. Для пеногашения состав может быть дополнен резиновой крошкой, спиртовыми частицами или кислотами.
Для пеногашения состав может быть дополнен резиновой крошкой, спиртовыми частицами или кислотами.
Состав буровых растворов
Приготовление буровых растворов требует использования тонкодисперсионных глиняных веществ с высокой степенью пластичности и невысоким процентом песчаных частиц: они могут создавать вязкую суспензию в контакте с водой, которая не будет давать осадка в течение долгого времени. Наилучшими свойствами обладают разновидности глиняных порошков на основе щелочных составов, и они дают растворы с невысоким показателем плотности.
При создании бурового раствора важно следить, чтобы туда не попали вредные примеси, к которым относится гипс, частицы известняка, а также соли, способные растворяться в воде. По техническим требованиям, главным показателем качества сырья в виде порошка или глины считается выход раствора, т.е. число кубометров нужной вязкости, которые получаются из тонны сырья. Важными показателями также считаются такие параметры, как плотность и число песка в составе.
Назначение буровых растворов
Приготовление буровых растворов преследует ряд важных целей:
- Охлаждение поверхностей долот и их смазывание. Поскольку работа такого оборудования сопровождается возникновением большого трения, основным назначением состава является смазывание и уменьшение температуры, что повышает износостойкость техники.
- Очистка забоя. Большинство типов растворов позволяет эффективно вымыть из скважины выбуренную породу, а также вынести ее на поверхность. Качество и степень очистки определяется физико-химическими свойствами составов, а также геологическими особенностями, поэтому в приготовлении нужно учесть и состав пород месторождения.
- Создание очистного слоя на стенках ствола. Формируемая корка имеет невысокую проницаемость, поэтому она обеспечивает устойчивость песков в верхней зоне разреза и разделяет скважину и проницаемые слои.
- Предупреждение проявлений нефти, газа и пластовой воды.

- Защита от обвалов стенок, которые могут произойти в случае наличия в составе пород неустойчивой глины.
- Еще одно назначение – обеспечение высокого качества вскрытия горизонтов: большинство видов современных растворов позволяет не допустить их загрязнения в процессе бурения, а также избежать полного закупоривания, делающего разработку очень трудной.
- Снижение затрат на фиксацию при помощи колонн.
- Получение данных для анализа при работе разведывательных скважин является одним из вспомогательных назначений раствора; предметом изучения является шлам и выносимые части породы.
- Повышение устойчивости труб и оборудования к коррозии.
- Последнее назначение – обеспечение техники безопасности в процессе разработки и минимизация вреда для окружающей среды и экологической обстановки района.
Виды и типы буровых растворов
Современная классификация включает следующие виды жидкостей для промывки:
- Растворы на основе воды.
 В эту категорию выделяют безглинистые составы (техническая вода, растворы, суспензии и средства на основе полимеров), глинистые вещества (на основе пресной, минерально воде, гипсовые, глиняные и хлорные растворы).
В эту категорию выделяют безглинистые составы (техническая вода, растворы, суспензии и средства на основе полимеров), глинистые вещества (на основе пресной, минерально воде, гипсовые, глиняные и хлорные растворы). - Растворы на неводной основе: составы с углеводородами, нефтепродуктами с минимальным содержанием газа.
- Жидкости аэрированного типа, пены.
- Газообразные реагенты.
Приготовление буровых растворов
Если в скважине есть залежи глины коллоидного типа, то жидкость для промывки образуется там при бурении ствола. Когда вода попадает в ствол, она диспергирует глиняный состав, частицы которого выбуриваются инструментом, и создается раствор на основе глины; его качество зависит от объема воды и может быть улучшено посредством добавления химических элементов. Такой способ является наименее затратным по средствам и силам.
Также раствор может приготавливаться в мешалках, где глину соединяют с водой и активно перемешивают. В случае необходимости улучшения свойств туда добавляют реагенты (они могут увеличить или уменьшить плотность, вязкость и другие качества). После приготовления проводится очистка жидкости, для чего в стволе формируется специальный желоб с перегородками: по нему жидкость проводится до устья и фильтруется от примесей.
В случае необходимости улучшения свойств туда добавляют реагенты (они могут увеличить или уменьшить плотность, вязкость и другие качества). После приготовления проводится очистка жидкости, для чего в стволе формируется специальный желоб с перегородками: по нему жидкость проводится до устья и фильтруется от примесей.
Компания СНК осуществляет сервис буровых растворов, который включает согласование технических особенностей, обследование оборудования, доставку материалов с приготовлением растворов нужного типа, анализ, контроль качества и многое другое. Подробности можно узнать на официальном сайте организации..
Карамовское месторождение: мультибур
Читайте также:
Динамическое приготовление раствора при производстве контактных линз
Контактные линзы являются эффективным средством коррекции зрения. По статистике количество людей, пользующихся линзами, давно превысило 100 млн. человек и продолжает расти. Насыщение рынка высококачественной продукцией, которая была бы безопасной и удобной для ношения, – серьёзная задача для производителей контактных линз.
По статистике количество людей, пользующихся линзами, давно превысило 100 млн. человек и продолжает расти. Насыщение рынка высококачественной продукцией, которая была бы безопасной и удобной для ношения, – серьёзная задача для производителей контактных линз.
В процессе изготовления и упаковки линз применяется раствор, состоящий из очищающей жидкости и физраствора. Сложность в применении такого раствора состоит в том, что его срок хранения не превышает 20 часов при пониженной температуре. Это связано в первую очередь с угрозой образования бактерий в растворе. Поэтому зачастую на производстве вынуждены периодически готовить партии раствора в объеме нескольких десятков кубических метров в резервуарах. При смене партий раствора основной производственный конвейер простаивает.
Компания Bronkhorst помогла решить эту проблему с помощью пропорциональных дозирующих систем. Это позволило увеличить выпуск продукции и значительно сократить производственные затраты. Предложенная схема динамического приготовления раствора очищающей жидкости и физраствора представлена на рисунке.
Кориолисовый расходомер M55 серии CORI-FLOW с насосом осуществляет дозирование основного потока физраствора. В соответствии с потребностями технологического процесса значение уставки для расходомера М55 периодически изменяется. Система управления верхнего уровня передаёт величину уставки по цифровой шине DeviceNet.
Функция кориолисового расходомера М14 серии miniCORI-FLOW с насосом состоит в пропорциональном дозировании очищающей жидкости в физраствор в режиме ведомого. В зависимости от текущего расхода М55 и от величины коэффициента пропорциональности, записанного в память расходомера М14, он автоматически формирует своё значение уставки. Этот процесс осуществляется на уровне логики самого расходомера, автоматика верхнего уровня здесь не нужна. В результате достигается высокое быстродействие и очень точное поддержание массовых долей компонентов раствора.
Компактная конструкция расходомеров-дозаторов Bronkhorst®, в которой кориолисовые измерители М55 и М14 и управляемые ими насосы смонтированы в одном компактном блоке, явились ключевым фактором при выборе решения Bronkhorst® одним из европейских производителей контактных линз.
К несомненным преимуществам непрерывного процесса дозирования является отказ от громоздких резервуаров для приготовления партии раствора. В данном случае использовались ёмкости объемом 17 000 литров. Также удалось снизить потери очищающей жидкости, благодаря высокоточному принципу измерения кориолисовых расходомеров.
Во многих технологических задачах требуются компактные, точные системы измерения и контроля пропорционального дозирования присадок в основной поток. Используя расходомеры серий CORI-FLOW и miniCORI-FLOW, легко настроить компактные автономные рабочие системы, которые предлагают необходимую функциональность без использования внешнего компьютерного оборудования и программного обеспечения.
После запуска этой системы дозирования производитель контактных линз провёл испытания по изучению возможностей роста бактерий внутри расходомеров и насосов. По требованиям заказчика система должна была оставаться стерильной не менее 13 недель (период планового техобслуживания всего производственного комплекса).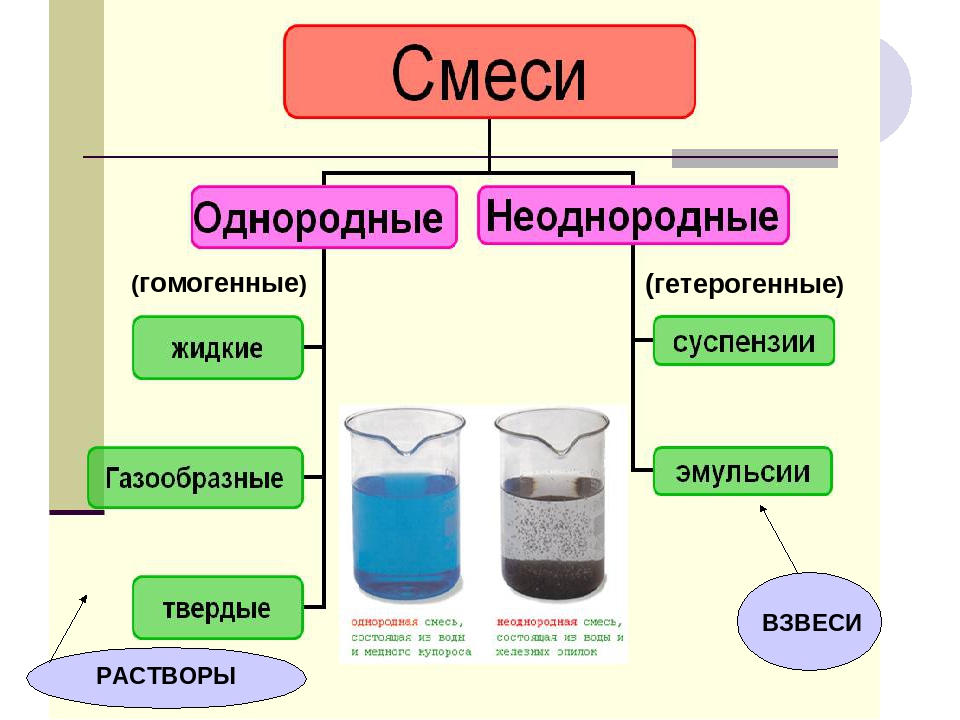 После 26 недель тестирования роста бактерий не было обнаружено, что полностью удовлетворило требования заказчика.
После 26 недель тестирования роста бактерий не было обнаружено, что полностью удовлетворило требования заказчика.
По материалам https://www.bronkhorst.com/files/applications/a027c-liquidmixingsystems.pdf
Что такое решение?
Что такое решение? Что такое решение?Раствор представляет собой гомогенную смесь одного или нескольких растворенных веществ, растворенных в растворителе.
- растворитель : вещество, в котором растворенное вещество растворяется с образованием гомогенной смеси
- растворенное вещество : вещество, которое растворяется в растворителе с образованием гомогенной смеси
Обратите внимание, что растворитель — это вещество, которое присутствует в наибольшем количестве.
Существует множество различных решений. Например, растворенное вещество может быть газом, жидкостью или твердым веществом. Растворителями также могут быть газы, жидкости или твердые вещества.
На следующих рисунках показано поведение нескольких различных типов растворов под микроскопом. Обратите внимание, что в каждом случае частицы растворенного вещества равномерно распределяются среди частиц растворителя.
| Вид под микроскопом газа Br 2 (растворенного вещества), растворенного в газе Ar (растворитель). | Вид под микроскопом газообразного аргона (растворенного вещества), растворенного в жидкости H 2 O (растворитель). |
Вид под микроскопом Br 2 жидкости (растворенного вещества), растворенного в жидкости H 2 O (растворитель). | Вид под микроскопом твердого NaCl (растворенного вещества), растворенного в жидкости H 2 O (растворитель). Обратите внимание, что твердое ионное вещество NaCl при растворении в воде образует ионы Na + (синий) и ионы Cl — (зеленый). |
| Вид под микроскопом твердого Kr (растворенного вещества, синий ), растворенного в твердом Xe (растворитель, красный ). |
9.1: Смеси и растворы — Chemistry LibreTexts
Цели обучения
- Чтобы понять, что вызывает формирование решений.
Раствор — это еще одно название гомогенной смеси. Смесь как материал, состоящий из двух или более веществ.В растворе комбинация настолько близка, что различные вещества невозможно различить визуально даже с помощью микроскопа. Сравните, например, смесь соли и перца и другую смесь, состоящую из соли и воды. В первой смеси мы легко можем увидеть отдельные крупинки соли и крупинки перца. Смесь соли и перца не раствор. Однако во второй смеси, как бы внимательно мы ни смотрели, мы не можем увидеть два разных вещества. Соль, растворенная в воде, представляет собой раствор.
Сравните, например, смесь соли и перца и другую смесь, состоящую из соли и воды. В первой смеси мы легко можем увидеть отдельные крупинки соли и крупинки перца. Смесь соли и перца не раствор. Однако во второй смеси, как бы внимательно мы ни смотрели, мы не можем увидеть два разных вещества. Соль, растворенная в воде, представляет собой раствор.
Главный компонент раствора, называемый растворителем , обычно представляет собой ту же фазу, что и сам раствор. Каждый второстепенный компонент раствора (а их может быть более одного) называется растворенным веществом . В большинстве решений, которые мы опишем в этом учебнике, не будет двусмысленности в том, является ли компонент растворителем или растворенным веществом. Например, в растворе соли в воде растворенное вещество представляет собой соль, а растворитель — воду.
Растворы бывают во всех фазах, и растворитель и растворенное вещество не обязательно должны находиться в одной и той же фазе для образования раствора (например, соли и воды). Например, воздух представляет собой газообразный раствор, состоящий примерно из 80% азота и примерно 20% кислорода, при этом некоторые другие газы присутствуют в гораздо меньших количествах. Сплав — это твердый раствор, состоящий из металла (например, железа) с растворенными в нем другими металлами или неметаллами. Сталь, сплав железа и углерода и небольшого количества других металлов, является примером твердого раствора. В таблице \ (\ PageIndex {1} \) перечислены некоторые общие типы решений с примерами каждого из них.
Например, воздух представляет собой газообразный раствор, состоящий примерно из 80% азота и примерно 20% кислорода, при этом некоторые другие газы присутствуют в гораздо меньших количествах. Сплав — это твердый раствор, состоящий из металла (например, железа) с растворенными в нем другими металлами или неметаллами. Сталь, сплав железа и углерода и небольшого количества других металлов, является примером твердого раствора. В таблице \ (\ PageIndex {1} \) перечислены некоторые общие типы решений с примерами каждого из них.
| Фаза растворителя | Растворенная фаза | Пример |
|---|---|---|
| газ | газ | воздух |
| жидкость | газ | газированные напитки |
| жидкость | жидкость | этанол (C 2 H 5 OH) в H 2 O (алкогольные напитки) |
| жидкость | цельный | соленая вода |
| цельный | газ | H 2 Газ, абсорбированный металлическим Pd |
| цельный | жидкость | Hg (ℓ) в зубных пломбах |
| цельный | цельный | стальных сплавов |
Что вызывает образование раствора? Простой ответ заключается в том, что растворитель и растворенное вещество должны иметь схожие межмолекулярные взаимодействия. В этом случае отдельные частицы растворителя и растворенного вещества могут легко смешиваться так тесно, что каждая частица растворенного вещества окружена частицами растворенного вещества, образуя раствор. Однако, если два вещества имеют очень разные межмолекулярные взаимодействия, требуется большое количество энергии, чтобы заставить их отдельные частицы тесно смешаться, поэтому раствор не образуется. Таким образом, два алкана, такие как n -гептан, C 7 H 16 и n -гексан, C 6 H 14 , полностью смешиваются во всех пропорциях.Молекулы C 7 H 16 и C 6 H 14 настолько похожи (вспомните раздел 4.6), что различия в межмолекулярных силах незначительны.
В этом случае отдельные частицы растворителя и растворенного вещества могут легко смешиваться так тесно, что каждая частица растворенного вещества окружена частицами растворенного вещества, образуя раствор. Однако, если два вещества имеют очень разные межмолекулярные взаимодействия, требуется большое количество энергии, чтобы заставить их отдельные частицы тесно смешаться, поэтому раствор не образуется. Таким образом, два алкана, такие как n -гептан, C 7 H 16 и n -гексан, C 6 H 14 , полностью смешиваются во всех пропорциях.Молекулы C 7 H 16 и C 6 H 14 настолько похожи (вспомните раздел 4.6), что различия в межмолекулярных силах незначительны.
По той же причине метанол, CH 3 OH, полностью смешивается с водой. В этом случае обе молекулы полярны и могут образовывать водородные связи между собой, поэтому внутри каждой жидкости существует сильное межмолекулярное притяжение. Однако диполи CH 3 OH могут выравниваться с диполями H 2 O, а молекулы CH 3 OH могут связываться водородом с молекулами H 2 O, и поэтому притяжения между разнородными молекулами в растворе аналогичны таковым. среди подобных молекул в каждой чистой жидкости.
Однако диполи CH 3 OH могут выравниваться с диполями H 2 O, а молекулы CH 3 OH могут связываться водородом с молекулами H 2 O, и поэтому притяжения между разнородными молекулами в растворе аналогичны таковым. среди подобных молекул в каждой чистой жидкости.
Этот процесс приводит к простому практическому правилу: как растворяется. Очень полярные растворители растворяют очень полярные или даже ионные растворенные вещества. Неполярные растворители растворяют неполярные растворенные вещества. Таким образом, вода, будучи полярной, является хорошим растворителем для ионных соединений и полярных растворенных веществ, таких как этанол (C 2 H 5 OH). Однако вода не растворяет неполярные растворенные вещества, такие как многие масла и смазки (Рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \): стакан содержит воду с синим пищевым красителем (верхний жидкий слой) и гораздо более плотным перфторгептаном (фторуглеродом) нижний жидкий слой. Эти две жидкости не могут смешиваться, и краситель не может растворяться во фторуглероде. В воду завели золотую рыбку и краба. Золотая рыбка не может проникнуть в плотный фторуглерод. Краб плавает на границе жидкости, только части его ног проникают во фторуглеродную жидкость и не могут опуститься на дно стакана. На дно стакана лежит четверть монеты. Животные были спасены из затруднительного положения после того, как была сделана фотография. Рисунок использован с разрешения Википедии (Сбхаррис (Стивен Б.Харрис)) .
Эти две жидкости не могут смешиваться, и краситель не может растворяться во фторуглероде. В воду завели золотую рыбку и краба. Золотая рыбка не может проникнуть в плотный фторуглерод. Краб плавает на границе жидкости, только части его ног проникают во фторуглеродную жидкость и не могут опуститься на дно стакана. На дно стакана лежит четверть монеты. Животные были спасены из затруднительного положения после того, как была сделана фотография. Рисунок использован с разрешения Википедии (Сбхаррис (Стивен Б.Харрис)) . Мы используем слово «растворимый» для описания растворенного вещества, которое растворяется в определенном растворителе, а слово «нерастворимый» — для растворенного вещества, которое не растворяется в растворителе. Таким образом, мы говорим, что хлорид натрия растворим в воде, но не растворим в гексане (C 6 H 14 ). Если растворенное вещество и растворитель являются жидкими и растворимыми в любой пропорции, мы используем слово «смешиваемый» и слово «несмешиваемый», если это не так.
Пример \ (\ PageIndex {1} \)
Вода считается полярным растворителем.Какие вещества должны растворяться в воде?
- метанол (CH 3 OH)
- сульфат натрия (Na 2 SO 4 ) Октановое число
- (C 8 H 18 )
Решение
Поскольку вода полярна, в ней растворяются полярные или ионные вещества.
- Из-за наличия группы ОН в метаноле мы ожидаем, что его молекулы будут полярными. Таким образом, мы ожидаем, что он растворим в воде.Поскольку и вода, и метанол являются жидкостями, слово смешиваемый можно использовать вместо растворимый .
- Сульфат натрия — ионное соединение, поэтому мы ожидаем, что он растворим в воде.
- Как и другие углеводороды, октан неполярен, поэтому мы ожидаем, что он не будет растворяться в воде.
Упражнение \ (\ PageIndex {1} \)
Толуол (C 6 H 5 CH 3 ) широко используется в промышленности в качестве неполярного растворителя. Какие вещества должны растворяться в толуоле?
Какие вещества должны растворяться в толуоле?
- вода (H 2 O)
- сульфат натрия (Na 2 SO 4 ) Октановое число
- (C 8 H 18 )
- Ответ
- Только октановое число
.
Пример \ (\ PageIndex {2} \)
Предскажите, какое из следующих соединений будет наиболее растворимо в воде:
- \ (\ underset {\ text {этанол}} {\ mathop {\ text {CH} _ {\ text {3}} \ text {CH} _ {\ text {2}} \ text {OH}}} \, \)
- \ (\ underset {\ text {гексанол}} {\ mathop {\ text {CH} _ {\ text {3}} \ text {CH} _ {\ text {2}} \ text {CH} _ {\ текст {2}} \ text {CH} _ {\ text {2}} \ text {CH} _ {\ text {2}} \ text {CH} _ {\ text {2}} \ text {OH}} } \, \)
Решение
Поскольку этанол содержит группу OH , он может образовывать водородные связи с водой.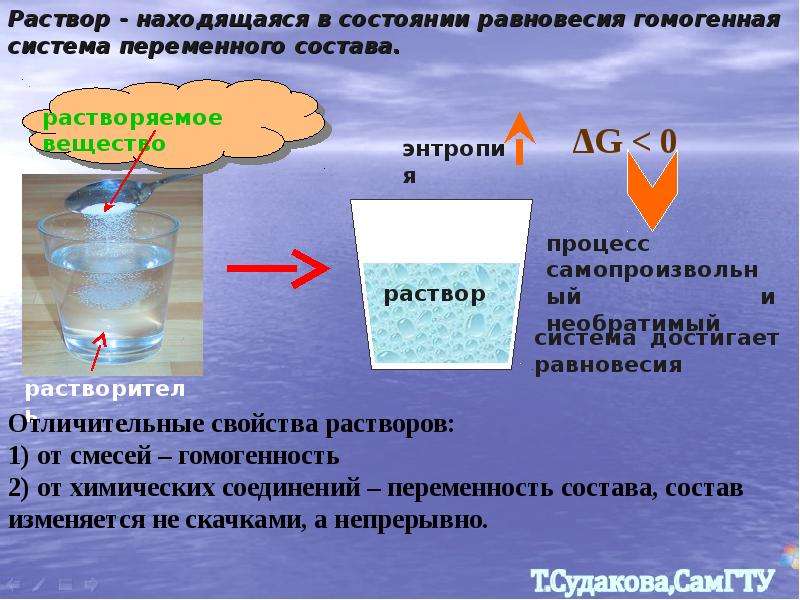 Хотя то же самое и с гексанолом, группа ОН находится только на одном конце довольно большой молекулы. Можно ожидать, что остальная часть молекулы будет вести себя так, как если бы она была неполярным алканом. Таким образом, это вещество должно быть гораздо менее растворимо, чем первое. Экспериментально мы обнаружили, что этанол полностью смешивается с водой, в то время как только 0,6 г гексанола растворяется в 100 г воды.
Хотя то же самое и с гексанолом, группа ОН находится только на одном конце довольно большой молекулы. Можно ожидать, что остальная часть молекулы будет вести себя так, как если бы она была неполярным алканом. Таким образом, это вещество должно быть гораздо менее растворимо, чем первое. Экспериментально мы обнаружили, что этанол полностью смешивается с водой, в то время как только 0,6 г гексанола растворяется в 100 г воды.
Упражнение \ (\ PageIndex {2} \)
Будет ли I 2 более растворимым в CCl 4 или H 2 O?
- Ответ
I 2 неполярный.Из двух растворителей CCl 4 неполярен, а H 2 O полярен, поэтому можно ожидать, что I 2 будет более растворим в CCl 4 .
Упражнения по обзору концепции
- Что вызывает образование раствора?
- Как фраза « как растворяется как » относится к растворам?
ответы
- Растворы образуются, потому что растворенное вещество и растворитель имеют схожие межмолекулярные взаимодействия.

- Это означает, что вещества со схожими межмолекулярными взаимодействиями будут растворяться друг в друге.
Key Takeaway
- Растворы образуются из-за сходных межмолекулярных взаимодействий растворенного вещества и растворителя.
Упражнения
Приведите несколько примеров решений.
В чем разница между растворителем и растворенным веществом?
Может ли раствор содержать более одного растворенного вещества? Вы можете привести пример?
Должен ли раствор быть жидким? Приведите несколько примеров, подтверждающих ваш ответ.
Приведите хотя бы два примера решений, обнаруженных в организме человека.
Какие вещества, вероятно, будут растворимы в воде, очень полярном растворителе?
- нитрат натрия (NaNO 3 )
- гексан (C 6 H 14 )
- изопропиловый спирт [(CH 3 ) 2 CHOH]
- бензол (C 6 H 6 )
Какие вещества, вероятно, будут растворимы в толуоле (C 6 H 5 CH 3 ), неполярном растворителе?
- нитрат натрия (NaNO 3 )
- гексан (C 6 H 14 )
- изопропиловый спирт [(CH 3 ) 2 CHOH]
- бензол (C 6 H 6 )
Растворимость спиртов в воде зависит от длины углеродной цепи.
 Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.
Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.Диметилсульфоксид [(CH 3 ) 2 SO] — полярная жидкость. Основываясь на информации из упражнения 9, что, по вашему мнению, будет в нем более растворимо — этанол или гептанол?
ответы
2.уксус, декстроза IV, физиологический раствор IV, кофе, чай, вино
Растворитель является основным компонентом раствора; растворенное вещество является второстепенным компонентом раствора.
4. да. Кока-кола или пепси содержат в качестве растворенных веществ сахар, кофеин и углекислый газ.
Раствор не обязательно должен быть жидким; воздух — это газообразный раствор, а некоторые сплавы — твердые растворы (ответы будут разными).
6.Моча, плазма
- вероятно растворимый
- вероятно не растворим
- вероятно растворимый
- вероятно не растворим
- вероятно не растворим
- вероятно растворимый
- вероятно не растворим
- вероятно растворимый
9. Небольшие молекулы спирта имеют сильные полярные межмолекулярные взаимодействия, поэтому они растворяются в воде.В больших молекулах спирта неполярный конец подавляет полярный конец, поэтому они плохо растворяются в воде.
10. Этанол — меньшая молекула. Он будет более растворим в воде, чем гептанол.
Реакции в растворе — Химия LibreTexts
Раствор состоит из двух или более веществ, растворенных в жидкой форме. Не путайте со смесью , которая является гетерогенной — существует множество веществ с разной структурой — растворы гомогены, что означает, что атомы растворенного вещества равномерно распределены по всему растворителю (напр.вода, этанол). Думайте об этом, как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — это вещество, осуществляющее растворение.
Не путайте со смесью , которая является гетерогенной — существует множество веществ с разной структурой — растворы гомогены, что означает, что атомы растворенного вещества равномерно распределены по всему растворителю (напр.вода, этанол). Думайте об этом, как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — это вещество, осуществляющее растворение.
отл.
Раствор NaCl в воде Смесь блоков лего и воды
Примечание: все растворы являются смесями, но не все смеси являются растворами.
Растворители
Вода (H 2 O) — наиболее распространенный растворитель, используемый для растворения многих соединений или приготовления кофе.К другим распространенным растворителям относятся скипидар (разбавитель для краски), ацетон (жидкость для снятия лака) и этанол (используется в некоторых духах). Такие растворители обычно содержат углерод и называются органическими растворителями. Растворы с водой в качестве растворителя называются водными растворами; у них есть особые свойства, о которых здесь говорится.
Растворы с водой в качестве растворителя называются водными растворами; у них есть особые свойства, о которых здесь говорится.
Растворенные вещества
Различные химические соединения растворяются в растворенных веществах в разной степени. Некоторые соединения, такие как сильнокислая соляная кислота (HCl), полностью диссоциируют в растворе на ионы.Другие, такие как слабый щелочной аммиак (NH 3 ), диссоциируют только частично. Однако другие соединения, такие как спирт, вообще не диссоциируют и остаются соединениями. В лабораторных реакциях часто используются кислоты и основания, о которых здесь подробнее рассказывается.
Концентрация
Концентрация — это мера количества растворенного вещества в определенном количестве растворителя. Знание концентрации раствора важно, помимо прочего, для определения силы кислоты или основания (pH).Когда в концентрации присутствует так много растворенного вещества, что оно больше не растворяется, раствор становится насыщенным.
Ученые часто используют молярность для измерения концентрации.
молярность = моль / литр
Поскольку стехиометрия реакции зависит от молярных соотношений, молярность является основным измерением концентрации.
Менее распространенная единица измерения концентрации называется моляльностью .
Моляльность = моль / кг растворителя
Ученые иногда используют молярность для измерения концентрации, потому что объемы жидкости незначительно меняются в зависимости от температуры и давления.Однако масса остается неизменной, и ее можно точно измерить с помощью весов. Коммерческие концентрированные продукты обычно выражаются в массовых процентах; такие как техническая концентрированная серная кислота, которая составляет 93-98% H 2 SO 4 по массе в воде (Hill, Petrucci 116).
Принятие решения
Растворы, используемые в лаборатории, обычно состоят из твердых растворенных веществ (часто солей) или исходных растворов.
Чтобы приготовить раствор из твердых растворенных веществ, сначала вычислите, сколько молей растворенного вещества находится в желаемых растворах (используя молярность).Вычислите необходимое количество твердого вещества в граммах, используя необходимые моли и молярную массу растворенного вещества, и взвесьте необходимое количество. Перенесите растворенное вещество в контейнер (желательно в мерную колбу, которая наиболее точно измеряет объем раствора, указанный на колбе) и добавьте небольшое количество растворителя. Тщательно перемешайте до растворения растворенного вещества. После растворения растворенного вещества добавьте оставшийся растворитель, чтобы получить раствор желаемого объема, и тщательно перемешайте.
Например, чтобы сделать 0.5 литров 0,5 молярного NaCl:
1. Умножьте концентрацию (0,5 моль / литр) на объем раствора, который вам нужен (0,5 литра), чтобы найти нужное количество молей NaCl.
0,5 моль / литр * 0,5 литра = 0,25 моль NaCl
2. Умножьте моли NaCl на его молярную массу (58,44 г / моль), чтобы найти необходимые граммы растворенного вещества.
Умножьте моли NaCl на его молярную массу (58,44 г / моль), чтобы найти необходимые граммы растворенного вещества.
(0,25 моль NaCl) * (58,44 г / моль) = 14,61 г NaCl
Приготовление раствора определенной концентрации из основного раствора называется разбавлением.При разбавлении раствора имейте в виду, что добавление растворителя в раствор изменяет концентрацию раствора, но не количество уже присутствующего растворенного вещества.
Чтобы разбавить раствор с известной концентрацией, сначала определите количество молей растворенного вещества в растворе, умножив молярность на объем (в литрах). Затем разделите на желаемую молярность или объем, чтобы найти необходимый объем или концентрацию.Используемое уравнение — просто
M 1 V 1 = M 2 V 2
M 1 и V 1 — концентрация и объем исходного (исходного) раствора для разбавления; M 2 и V 2 — желаемая концентрация и объем конечного раствора.
Стехиометрия раствора
Для реакций, протекающих в растворах:
- Рассчитайте количество молей растворенного вещества в реакции, умножив концентрацию (молярность) на объем раствора (литры)
- Определить ограничивающий реагент, если есть один
- Следуйте стехиометрическому процессу.
- Преобразуйте полученные моль растворенного вещества обратно в молярность, разделив на общий объем в литрах раствора, использованного в реакции.
- В случае реакций с участием ионов (например, в реакциях между сильными кислотами и основаниями) исключить ионы-наблюдатели из общего ионного уравнения. Ионы-наблюдатели в уравнениях не реагируют.
- Если концентрация не указана, но указаны молярная масса и объем, используйте плотность (граммы / литр), чтобы найти количество растворенного вещества в граммах, затем преобразуйте его в моль.
Список литературы
- Хилл, Петруччи. Общая химия: комплексный подход, второе издание.Нью-Джерси: Прентис-Холл, 1999.
- Петруччи, Харвуд, Селедка, Мадура. Общая химия: принципы и современные приложения, девятое издание. Нью-Джерси: Прентис-Холл, 2007.
Проблемы
- Раствор готовят растворением 44,6 г ацетона (OC (CH 3 ) 2 ) в воде с получением 1,50 л раствора. Какая молярность полученного раствора?
- Для определенной лабораторной процедуры требуется 0,025 M H 2 SO 4 .Сколько миллилитров 1,10 M H 2 SO 4 следует разбавить водой, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?
- Образец насыщенного NaNO 3 (водн.) — 10,9 M при 25 градусах Цельсия. Сколько граммов NaNO 3 содержится в 230 мл этого раствора при той же температуре?
- Стакан с 175 мл 0,950 М NaCl оставляют открытым на некоторое время. Если к концу периода времени объем раствора в химическом стакане уменьшился до 137 мл (потеря объема происходит из-за испарения воды), какова результирующая концентрация раствора?
- Студент готовит раствор, растворяя 15.0 мл этанола (C 2 H 5 OH) в воде с получением 300,0 мл раствора. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г / мл)
Авторы и указание авторства
Гиперглоссарий MSDS: Решение
Гиперглоссарий MSDS: РешениеОпределение
Раствор представляет собой однородную смесь двух или более веществ. Вещество, которое присутствует в наибольшем количестве, называется растворителем, а вещество, присутствующее в меньшем количестве, называется растворенным веществом.
В растворе может быть только один растворитель, но может быть много растворенных веществ. Хороший пример — газированная вода — растворителем является вода, а растворенные вещества включают двуокись углерода, сахар, ароматизаторы, карамельный краситель и т. Д.
Дополнительная информация
Растворы могут быть твердыми, жидкостями или газами. Конечное состояние раствора при заданном наборе условий зависит от материалов и их физических и химических свойств. Некоторые примеры включают:
| Компонент 1 | Компонент 2 | Раствор | Примеры |
|---|---|---|---|
| Твердый | Твердый | Твердый | Латунь (смесь ~ 70% меди и ~ 30% цинка), «серебряные» зубные пломбы ( твердое вещество, смесь олова и ртути в соотношении 8: 1) |
| Твердое вещество | Жидкое | Жидкое | Сахар, растворенный в воде, соленая вода. |
| Твердое вещество | Газ | Твердое вещество | Газообразный водород, адсорбированный на металлическом палладии |
| Жидкость | Газ | Жидкость | Диоксид углерода, растворенный в воде (газированная вода) |
| Жидкость | Жидкость | Жидкость | Спирт в воде, антифриз (этиленгликоль в воде), бензин (сложная смесь углеводородов) |
| Газ | Газ | Газ | Воздух, природный газ (в основном метан и этан), синтез-газ (смесь водорода и окиси углерода). |
Раствор, в котором присутствует некоторое количество твердого вещества, представляет собой не раствор, а гетерогенную смесь.
Решения делятся на три общих класса:
- Ненасыщенные растворы способны растворять больше растворенного вещества.
- Насыщенные растворы растворили максимальное количество растворенного вещества, возможное при данной температуре. Это определяет растворимость растворенного вещества в растворителе.
- Перенасыщенные растворы содержат больше растворенных веществ, чем их содержится в насыщенном растворе.
Этот последний предмет звучит подозрительно — как что-то может удерживать больше материала, чем оно может вместить? Лучше всего это проиллюстрировать на примере:
Мы знаем, что горячая вода растворяет больше сахара, чем холодная. Когда мы охлаждаем насыщенный раствор горячей воды с сахаром, вода больше не может удерживать весь сахар в растворенном состоянии. Некоторое количество сахара должно кристаллизоваться из раствора. Однако для кристаллизации требуется место зародышеобразования, такое как другой кристалл сахара или пятнышко ворса для роста кристалла.Если наш контейнер будет безупречно чистым, кристаллам негде начать расти! Но если мы добавим кристалл сахара в перенасыщенный раствор, «лишний» сахар будет быстро выпадать из этого метастабильного раствора, пока раствор снова не станет насыщенным. Есть несколько замечательных демонстраций этого принципа по общей химии; см. раздел «Дополнительная литература» ниже.
Когда твердое вещество осаждается из раствора, процесс называется кристаллизацией, если твердое вещество является кристаллическим, и осаждением, если твердое вещество представляет собой порошок или аморфный материал.Образовавшееся твердое вещество называется осадком, а оставшийся жидкий раствор называется супернатантом или «маточным раствором».
Соответствие паспорту безопасности (SDS)
Паспорта безопасностинеобходимы, чтобы указать физические и химические характеристики материала в Раздел 9 (физические и химические свойства), который включает растворимость (если известна). Кроме того, в паспортах безопасности могут обсуждаться свойства, стабильность или опасности растворов.«Раствор» также может фигурировать в Разделе 4 (меры первой помощи) (например, физиологические растворы) или в Разделе 6 (меры случайного выброса) процедур (например, «используйте раствор XX и YY, чтобы …») .
Дополнительная литература
См. Также : Единицы концентрации, моль, растворимость, растворитель, пар.
Дополнительные определения от Google и OneLook.
Последнее обновление записи: воскресенье, 11 октября 2020 г.Права на эту страницу принадлежат ILPI, 2000-2021 гг. Несанкционированное копирование или размещение на других веб-сайтах категорически запрещено. Присылайте нам предложения, комментарии и пожелания о новых записях (если возможно, укажите URL-адрес) по электронной почте.
Заявление об ограничении ответственности : Информация, содержащаяся в данном документе, считается правдивой и точной, однако ILPI не дает никаких гарантий относительно правдивости любого заявления. Читатель использует любую информацию на этой странице на свой страх и риск. ILPI настоятельно рекомендует читателям проконсультироваться с соответствующими местными, государственными и федеральными агентствами по вопросам, обсуждаемым здесь.
Решения
9.1 Решения
Цель обучения
- Поймите, что вызывает появление решений.
Раствор Другое название однородной смеси. — другое название однородной смеси. В главе 1 «Химия, вещество и измерения» смесь определяется как как материал, состоящий из двух или более веществ. В растворе комбинация настолько близка, что различные вещества невозможно различить визуально даже с помощью микроскопа.Сравните, например, смесь соли и перца и другую смесь, состоящую из соли и воды. В первой смеси мы легко можем увидеть отдельные крупинки соли и крупинки перца. Смесь соли и перца не раствор. Однако во второй смеси, как бы внимательно мы ни смотрели, мы не можем увидеть два разных вещества. Соль, растворенная в воде, представляет собой раствор.
Главный компонент раствора, называемый растворителем Главный компонент раствора, обычно представляет собой ту же фазу, что и сам раствор.Каждый второстепенный компонент раствора (а их может быть более одного) называется растворенным веществом. Незначительный компонент раствора. В большинстве решений, которые мы опишем в этом учебнике, не будет двусмысленности относительно того, является ли компонент растворителем или растворенное вещество.) Например, в растворе соли в воде растворенное вещество представляет собой соль, а растворитель представляет собой воду.
Растворы бывают во всех фазах, и растворитель и растворенное вещество не обязательно должны находиться в одной и той же фазе для образования раствора (например, соли и воды).Например, воздух представляет собой газообразный раствор, состоящий примерно из 80% азота и примерно 20% кислорода, при этом некоторые другие газы присутствуют в гораздо меньших количествах. Сплав — твердый раствор металла с растворенными в нем другими веществами. представляет собой твердый раствор, состоящий из металла (например, железа) с растворенными в нем другими металлами или неметаллами. Сталь, сплав железа и углерода и небольшого количества других металлов, является примером твердого раствора. В таблице 9.1 «Типы решений» перечислены некоторые общие типы решений с примерами каждого из них.
Таблица 9.1 Типы решений
| Фаза растворителя | Растворенная фаза | Пример |
|---|---|---|
| газ | газ | воздух |
| жидкость | газ | газированные напитки |
| жидкость | жидкость | этанол (C 2 H 5 OH) в H 2 O (алкогольные напитки) |
| жидкость | цельный | соленая вода |
| цельный | газ | H 2 Газ, абсорбированный металлическим Pd |
| цельный | жидкость | Hg (ℓ) в зубных пломбах |
| цельный | цельный | стальные сплавы |
Что вызывает образование раствора? Простой ответ заключается в том, что растворитель и растворенное вещество должны иметь схожие межмолекулярные взаимодействия.В этом случае отдельные частицы растворителя и растворенного вещества могут легко смешиваться так тесно, что каждая частица растворенного вещества окружена частицами растворенного вещества, образуя раствор. Однако, если два вещества имеют очень разные межмолекулярные взаимодействия, требуется большое количество энергии, чтобы заставить их отдельные частицы тесно смешаться, поэтому раствор не образуется.
Этот процесс приводит к простому практическому правилу: как растворяется. Очень полярные растворители растворяют очень полярные или даже ионные растворенные вещества.Неполярные растворители растворяют неполярные растворенные вещества. Таким образом, вода, будучи полярной, является хорошим растворителем для ионных соединений и полярных растворенных веществ, таких как этанол (C 2 H 5 OH). Однако вода не растворяет неполярные растворенные вещества, такие как многие масла и смазки (Рисунок 9.1 «Растворимость»).
Мы используем слово «растворимый» — растворенное вещество, которое растворяется в определенном растворителе. для описания растворенного вещества, которое растворяется в конкретном растворителе, и слово нерастворимое — растворенное вещество, которое не растворяется в конкретном растворителе.для растворенного вещества, которое не растворяется в растворителе. Таким образом, мы говорим, что хлорид натрия растворим в воде, но не растворим в гексане (C 6 H 14 ). Если растворенное вещество и растворитель являются жидкостями и растворимы в любой пропорции, мы используем слово смешиваемые жидкости, которые растворяются друг в друге, и слово несмешиваемые жидкости, которые не растворяются друг в друге. если их нет.
Пример 1
Вода считается полярным растворителем. Какие вещества должны растворяться в воде?
- метанол (CH 3 OH)
- сульфат натрия (Na 2 SO 4 ) Октановое число
- (C 8 H 18 )
Решение
Поскольку вода полярна, в ней растворяются полярные или ионные вещества.
- Из-за наличия группы ОН в метаноле мы ожидаем, что его молекулы будут полярными. Таким образом, мы ожидаем, что он растворим в воде. Поскольку и вода, и метанол являются жидкостями, слово смешиваемый можно использовать вместо растворимый .
- Сульфат натрия — ионное соединение, поэтому мы ожидаем, что он растворим в воде.
- Как и другие углеводороды, октан неполярен, поэтому мы ожидаем, что он не будет растворяться в воде.
Упражнения по развитию навыков
Толуол (C 6 H 5 CH 3 ) широко используется в промышленности в качестве неполярного растворителя.Какие вещества должны растворяться в толуоле?
Упражнения по обзору концепции
Что вызывает образование раствора?
Как фраза « как растворяется как » относится к растворам?
ответов
Растворы образуются, потому что растворенное вещество и растворитель имеют схожие межмолекулярные взаимодействия.
Это означает, что вещества со схожими межмолекулярными взаимодействиями будут растворяться друг в друге.
Key Takeaway
- Растворы образуются из-за сходных межмолекулярных взаимодействий растворенного вещества и растворителя.
Упражнения
Приведите несколько примеров решений.
В чем разница между растворителем и растворенным веществом?
Может ли раствор содержать более одного растворенного вещества? Вы можете привести пример?
Должен ли раствор быть жидким? Приведите несколько примеров, подтверждающих ваш ответ.
Приведите хотя бы два примера решений, обнаруженных в организме человека.
Какие вещества, вероятно, будут растворимы в воде, очень полярном растворителе?
- нитрат натрия (NaNO 3 )
- гексан (C 6 H 14 )
- изопропиловый спирт [(CH 3 ) 2 CHOH]
- бензол (C 6 H 6 )
Какие вещества, вероятно, будут растворимы в толуоле (C 6 H 5 CH 3 ), неполярном растворителе?
- нитрат натрия (NaNO 3 )
- гексан (C 6 H 14 )
- изопропиловый спирт [(CH 3 ) 2 CHOH]
- бензол (C 6 H 6 )
Растворимость спиртов в воде зависит от длины углеродной цепи.Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.
Диметилсульфоксид [(CH 3 ) 2 SO] — полярная жидкость.Основываясь на информации из упражнения 9, что, по вашему мнению, будет в нем более растворимо — этанол или гептанол?
ответов
Растворитель является основным компонентом раствора; растворенное вещество является второстепенным компонентом раствора.
Раствор не обязательно должен быть жидким; воздух — это газообразный раствор, а некоторые сплавы — твердые растворы (ответы будут разными).
- вероятно растворимый
- вероятно не растворим
- вероятно растворимый
- вероятно не растворим
Небольшие молекулы спирта имеют сильные полярные межмолекулярные взаимодействия, поэтому они растворяются в воде.В больших молекулах спирта неполярный конец подавляет полярный конец, поэтому они плохо растворяются в воде.
Глава 7 — Растворы — Химия
Глава 7: Растворы A Стехиометрия раствора 7.1 Введение 7.2 Типы решений 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7,6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в растворах 7,8 Разведения 7,9 Концентрации ионов в растворе 7.10 Внимание к окружающей среде: загрязнение свинцом 7.11 Резюме 7.12 Ссылки7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого. Решения повсюду вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение.Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворах, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите эти термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и перенасыщенные растворы.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту.Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения.Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 типа решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. С другой стороны, гетерогенные смеси неоднородны и имеют участки смеси, которые отличаются от других участков смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы . Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергируются и смешиваются с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду. Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео 7.1: Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 более высокая разность электроотрицательностей полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Like Dissolves Like.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода представляет собой высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разрушены частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl —. Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Точно так же решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не имеют сходных характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также помнить об этих других факторах.
(Вернуться к началу)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимо в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми на , чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, поскольку молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных целей, где это называется «котельная накипь», — нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 — (водн.) → CO 2 2− (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котле.
Рисунок 7.5 Весы котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах горячего водоснабжения могут значительно снизить пропускную способность труб. Эти отложения, называемые котельной накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В тепловое загрязнение , вода из озера или реки, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды составляет от 12,8 до 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите Focus Publication штата Вашингтон.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого является глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других питателей, которые затем уменьшили светопропускание, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того, как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кП
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — константа закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком малы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° CПарциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих аспектах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 — соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 — концентрация и парциальное давление, соответственно, газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют собой C 2 = ?? и P 2 = 5.0 атм. На этом этапе будет проще всего изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия: C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 : Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водн.) И Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.Когда бутылку открывают, давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой во внутренних жидкостях дайвера растворяется больше N 2 из воздуха. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и даже в некоторых случаях оказываясь фатальной.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низкие для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию O 2 во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Сообщается также, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi — 1/2
- моно — 1
- Sesqui — 1½
- Ди — 2
- Три — 3
- Тетра — 4
- Пента — 5
- Hexa — 6
- Hepta — 7
- Окта — 8
- Нона — 9
- Дека — 10
- Undeca — 11
- Додека — 12
Гидрат, потерявший воду, называют ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества гигроскопичны, и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный и высококонцентрированный напиток, тогда как слишком мало приводит к разбавленному раствору, который может быть трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при расчете задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении расчета.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Раствор:
(1) Измените приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рисунке 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
моль / литр.2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в растворахВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в обоих (т. Е. масс растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах, и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процент ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетии . Он также обозначает 1/100 (от L. centesimus ), как в сантиметре и денежной единице центов . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (b) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равен 1 экв / л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагирует или поставляет один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Раствор желаемой концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем.Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации. Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества. Помните, что разбавление данного количества исходного раствора растворителем не приводит к изменению , а не количества присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора, таким образом, может быть выражено математически как:
где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рисунок 7.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один ион Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2-.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2− ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2− и 2 моль катионов NH 4 + . (Молекулы воды не показаны с молекулярной точки зрения для ясности.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует трех ионов при растворении в воде (2NH 4 + + 1Cr 2 O 7 2−), общая концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 затем можно рассчитать, разделив 1,43 M на 4,29 M, получив 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 м (CH 3 ) CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Раствор:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH —, концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 —, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 — , так что 0,032 M In (NO 3 ) 3 Раствор содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)7.10 Внимание к окружающей среде: загрязнение свинцом История использования свинца в США
В главе 5 вы познакомились с EPA и с тем, как параметры качества воздуха отслеживаются для определения уровней загрязнения.Одним из шести основных параметров, за которым ведется мониторинг в соответствии с Законом о чистом воздухе, является свинец. Свинец естественным образом встречается в земной коре в очень низких концентрациях, ~ 0,001%, и выглядит как сине-серый металл, мягкий и плотный. Он широко используется в Соединенных Штатах во многих различных продуктах, включая батареи и смеси металлов, в качестве материала для пайки труб и керамики, хрусталя и других известных коммерческих продуктов. Особенно часто свинец использовался в красках для наружных работ и в качестве добавки к бензину (рис.7.12). Из-за растущих проблем со здоровьем использование свинца во многих продуктах было прекращено и прекращено. Однако загрязнение свинцом почвы, воды и воздуха по-прежнему является проблематичным и вызывает повышенный риск для здоровья населения.
Рисунок 7.12 История использования свинца в красках и бензине на протяжении большей части 20 века. График показывает раннее преобладание свинцовых красок, за которым последовал бум в транспортировке, что привело к высокому использованию этилированного бензина.Спад после середины 1970-х годов был связан с контролем, введенным EPA для исключения этилированного бензина. Источник: Filippelli и др. (2005) использовано с разрешения.
Национальные стандарты качества окружающего воздуха (NAAQS) для свинца установлены на верхнем пределе 0,15 микрограмма на кубический метр Pb в общем количестве взвешенных частиц в среднем за 3 месяца. Как видно из рисунка 7.13, уровни свинца в атмосфере были очень высокими до середины 1990-х годов, после чего мы наблюдали резкое падение уровней свинца в атмосфере.Этот всплеск содержания свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано отрицательное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения использования свинца в бензине. Полный запрет на этилированный бензин вступил в силу в 1996 году.
Рис. 7.13 Уровни содержания свинца в атмосфере с 1980 по 2014 год. (A) Как интерпретировать графики качества воздуха от EPA. синяя полоса показывает распределение уровней загрязнения воздуха среди участков тренда, отображая средние 80%.Белая линия представляет собой среднее значение по всем сайтам трендов. Девяносто процентов участков имеют концентрации ниже верхней линии, в то время как десять процентов участков имеют концентрации ниже нижней линии. (B) Максимальный годовой максимум за 3 месяца содержания свинца в атмосфере, демонстрирующий снижение уровня загрязнения свинцом на 99% с 1980 по 2017 год. Источник: EPA
Использование тетраэтилсвинца (TEL) было определено General Motors в качестве присадки к топливу, повышающей общее октановое число бензина.Это позволило значительно повысить компрессию двигателя, что привело к увеличению производительности автомобиля и большей экономии топлива.
TEL получают реакцией хлорэтана с натрием — свинцом сплавом
4 NaPb + 4 CH 3 CH 2 Cl → (CH 3 CH 2 ) 4 Pb + 4 NaCl + 3 Pb
Продукт регенерируют путем перегонки с водяным паром, оставляя отстой из отходов свинца и хлорида натрия.Несмотря на десятилетия исследований, не было обнаружено никаких реакций, улучшающих этот довольно сложный процесс, который включает металлический натрий и превращает только 25% свинца в TEL. ТЕЛ — вязкая бесцветная жидкость. Поскольку TEL является нейтральным по заряду и содержит внешние углеродные группы, он очень липофильный, (жиросодержащий) и растворим в бензине.
При сжигании этилированного бензина выделяется не только диоксид углерода и вода, но и свинец
(CH 3 CH 2 ) 4 Pb + 13 O 2 → 8 CO 2 + 10 H 2 O + Pb
Образующийся свинец также может окисляться при сгорании с образованием оксида свинца (II)
2 Pb + O 2 → 2 PbO
Образование Pb и PbO внутри автомобильного двигателя быстро накапливается в избытке и вызывает серьезные повреждения двигателя.Таким образом, молекулы, улавливающие свинец, также должны были быть добавлены в бензин для реакции с продуктами свинца, образующимися при сгорании. Обычно для этого процесса использовались 1,2-дибромэтан и 1,2-дихлорэтан. Эти агенты реагируют с побочными продуктами свинца и образуют летучий бромид свинца (II) и хлорид свинца (II), которые затем могут быть выброшены в атмосферу из двигателя.
Повышенные уровни свинца в атмосфере, вызванные использованием автомобилей, сильно коррелировали с повышенными уровнями свинца в крови среди населения.
7.14 Снижение среднего уровня свинца в крови у детей в США и общего количества свинца, использованного в год в бензине в 1974-1992 годах (адаптировано из U.S.EPA 1999).
Биологические эффекты свинца
После того, как свинец попадает в организм, он не выводится из организма. Вместо этого он накапливается в минерализующихся тканях, таких как кости и зубы, или в мягких тканях, таких как печень, почки и мозг. Мозг очень чувствителен. Проведенное в Цинциннати исследование продемонстрировало, что воздействие свинца в детстве вызывает потерю серого вещества в мозге, особенно в лобных областях, участвующих в исполнительной функции и принятии решений (рис.7.15).
Рис. 7.15. Воздействие свинца в детстве уменьшает размер мозга. Мозг взрослых, подвергшихся воздействию свинца в детстве, показывает уменьшенный объем, особенно в префронтальной коре на МРТ. Области потери объема показаны цветом на шаблоне нормального мозга. Источник: Cecil, KM, et al.
Острое воздействие свинца может вызвать отравление свинцом и вызвать боли в животе, запоры, головные боли, раздражительность, проблемы с памятью, неспособность иметь детей и покалывание в руках и ногах.Это вызывает почти 10% умственной отсталости по другой неизвестной причине и может привести к поведенческим проблемам. Некоторые эффекты постоянны. В тяжелых случаях возможны анемия, судороги, кома или смерть.
Воздействие свинца может происходить через загрязненный воздух, воду, пыль, продукты питания или товары широкого потребления что они едят. Воздействие свинца на работе — частая причина отравления свинцом у взрослых людей определенных профессий, которым грозит особый риск.Диагноз обычно ставится путем измерения уровня свинца в крови. Центры по контролю за заболеваниями (США) установили верхний предел содержания свинца в крови для взрослых на уровне 10 мкг / дл (10 мкг / 100 г) и для детей на уровне 5 мкг / дл.
Интересная корреляция: преступность и уровни содержания свинца в кровиРяд исследований, проведенных за последнее десятилетие, показали сильную корреляцию между уровнем свинца в крови дошкольного возраста и последующим уровнем преступности, особенно насильственных преступлений, произошедших 20 лет спустя (Рисунок 7.16).
Рис. 7.16. Соотношение уровней содержания свинца в крови в дошкольном возрасте и насильственных преступлений, совершенных 23 года спустя.
В начале 1990-х годов убийства и насильственные преступления достигли рекордного уровня, которому не видно конца. Однако к концу 1990-х годов количество насильственных преступлений по стране сократилось на 40%. Было предложено множество гипотез этого быстрого спада, включая увеличение числа заключенных и увеличение числа сотрудников полиции.Однако уровни свинца в крови показывают очень сильную корреляцию с частотой насильственных преступлений с запаздыванием примерно в 20 лет. Кроме того, исследования на животных, в том числе на хомяках и кошках, показали, что воздействие свинца увеличивает или усиливает агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные уровни тюремного заключения и охраны правопорядка, показывают аналогичные тенденции в насильственных преступлениях с уровнями свинца в крови у детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате употребления этилированного бензина объясняет, по крайней мере частично, рост уровня насильственной преступности в 1980-х и начале 1990-х годов в Соединенных Штатах.
Текущие проблемы и опасенияНесмотря на то, что использование свинца за последние 40-50 лет резко сократилось, он все еще может быть обнаружен в повышенных концентрациях в почвах, особенно в городских и промышленных районах.Кроме того, свинец ранее использовался для строительства водопроводных труб, поскольку он прочен и податлив. Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в стыках и соединениях которых использовалась свинцовая пайка. В апреле 2014 года это стало серьезной проблемой для жителей Флинта, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для обеспечения питьевой водой этого района.Экономия затрат оценивалась примерно в 10 миллионов долларов в год. Однако на строительство трубопровода потребуется несколько лет. Таким образом, чтобы сразу же сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт на время завершения строительства нового трубопровода. Однако с речной водой может быть труднее справиться из-за более сильных колебаний остатков стока, и почти сразу же жители Флинта, штат Мичиган, начали жаловаться на неприятный запах, некрасивую воду, идущую из кранов (рис.7.17).
Рисунок 7.17. Ли-Энн Уолтерс демонстрирует образцы водопроводной воды на публичном собрании в январе 2015 года. Источник: Ladapo, J.A, et. al. (2017).
Анализ воды первоначально показал высокий уровень фекальных колиформных бактерий, из-за чего Флинт, штат Мичиган, выпустил рекомендации по кипячению и увеличил количество хлора, используемого для обработки воды. Это, в свою очередь, увеличило производство тригалометанов. Тригалометаны образуются в результате реакции хлорных дезинфицирующих средств в воде с присутствующими органическими веществами, такими как те, которые образуются водорослями, присутствующими в реке Флинт.Тригалометаны связаны со многими проблемами со здоровьем, включая проблемы с печенью, почками и легкими, а также создают неприятный запах и привкус воды. Они также опасны при вдыхании, делая душ в горячей загрязненной воде серьезным риском для здоровья.
Таким образом, в попытке уменьшить образование побочных продуктов тригалогенметана, город Флинт начал добавлять в воду больше FeCl 3 , чтобы помочь удалить дополнительные органические материалы из этого источника воды.Однако они не смогли добавить никаких молекул, контролирующих коррозию, таких как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимого фосфата свинца, который не проникает в водопровод (рис. 7.18). Отсутствие контроля над коррозией со стороны города Флинт в сочетании с повышенным количеством FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl —. Результатом было общее увеличение потенциала коррозии, измеренное по массовому отношению хлорида к сульфату, от 0.45 для системы водоснабжения Детройта до 1,60 для новой системы водоснабжения реки Флинт. Имея такой потенциал коррозии, молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца выделялись окисленные формы железа, вызывающие большее обесцвечивание воды.
Рис. 7.18. Процесс коррозии во время водного кризиса во Флинте, штат Мичиган.
Чтобы получить интерактивную анимацию этого химического процесса, посмотрите этот
Видео журнала Scientific American — Коррозионная химия: как свинец попал в питьевую воду Флинта
Из-за протеста общественности и отказа города Флинта принимать меры в связи с плохим качеством воды компания Virgina Tech начала программу тестирования воды и обнаружила чрезвычайно высокие уровни свинца во многих домах во Флинте, штат Мичиган.CDC заявляет, что не существует безопасных уровней свинца, которые можно было бы употреблять, а стандарты EPA ограничивают содержание свинца в питьевой воде до 15 частей на миллиард. Самый высокий образец, зарегистрированный Технологическим институтом штата Вирджиния, составил 13 000 частей на миллиард из образца в доме Ли-Энн Уолтерс (рис. 7.17). Город Флинт вернулся к использованию системы водоснабжения Детройта в октябре 2015 года. Однако риск воздействия свинца на детей, находящихся в этом районе, превышающий установленные CDC предельные уровни в крови, за это время увеличился вдвое (рис. 7.19). Несколько судебных исков, находящихся на рассмотрении, в настоящее время находятся в стадии рассмотрения из-за халатности властей города Флинт и органов, регулирующих качество воды в регионе.
Рисунок 7.19. Сравнение уровней свинца в крови во Флинте, штат Мичиган, до и после переключения на источник воды из реки Флинт. Верхняя диаграмма показывает, что качество воды в 1 из 6 домов во Флинте, штат Мичиган, по результатам испытаний, превышающих пределы безопасности Агентства по охране окружающей среды на содержание свинца, после перехода на источник воды в реке Флинт. Нижняя панель показывает уровни свинца в крови у детей, регулярно проверяемые на уровни свинца в крови в районе как до, так и после перехода на новый источник воды. Источник: Flint Water Study
.Предлагаемое задание: Учителя могут загрузить дискуссионное задание на тему «Экологическая несправедливость и влияние токсичного загрязнения воды во Флинте, штат Мичиган,
».Flint Water Crisis Environmental Justice Assignment
7.11 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор — однородная смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор.Растворенные вещества — это растворимый или нерастворимый , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся и несмешиваемый вместо растворимых и нерастворимых используются для жидких растворенных веществ и растворителей. Утверждение « подобно растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит за счет сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора.Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества. Такими решениями являются насыщенный . Растворы с количеством меньше максимального — ненасыщенный . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объем / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Key Takeaway
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- ВЧ
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF — слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (M) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием основного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответов
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1,08 М, h4PO4 = 0,816 М, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
7.12 Ссылки
- Чанг (Питер) Чие (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д.У., Хилл, Дж. У. и Скотт, Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Нижний, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
- Мичиганская сеть по охране окружающей среды детей (2013 г.) Здоровье детей в окружающей среде в Мичигане.Вики по гигиене окружающей среды. Проверено 6 сентября 2018 г. по адресу: http://wiki.mnceh.org/index.php/Neurotoxicity:_Lead .
- авторов Википедии. (2018, 5 сентября). Отравление свинцом. В Википедия, Бесплатная энциклопедия . Получено 2:05, 7 сентября 2018 г., с https://en.wikipedia.org/w/index.php?title=Lead_poisoning&oldid=858177302 .
- Ладапо, Дж. А., Мохаммед, А. К., и Нвосу, В. (2017) Загрязнение свинцом во Флинте, Мичиган, США и других городах. Международный журнал экологического и научного образования, 11 (5): 1341-1351.Открытый доступ. Доступно по адресу: www.ijese.net/makale_indir/1899
Что такое решение?
Раствор представляет собой смесь одного вещества, растворенного в другом, поэтому свойства во всем одинаковы. Раствор состоит из растворенного вещества и растворителя. Растворенное вещество — это растворяемое вещество, а растворитель — это часть раствора, которая растворяет. Растворенное вещество имеет молекулярный размер.
Примеры решений:
| Газ | Жидкость | цельный | ||
|---|---|---|---|---|
| Газ | Кислород и другие газы в азоте (воздухе) | Водяной пар в воздухе (влажность) | Запах твердого вещества — молекулы этого твердого вещества растворяются в воздухе | |
| Жидкость | Двуокись углерода в воде (газированная вода) | Этанол (обычный спирт) в воде; различные углеводороды друг в друге (нефть) * | Сахароза (столовый сахар) в воде; натрия хлорид (поваренная соль) в воде | |
| Цельный | Водород, растворенный до палладия | Вода в активированном угле | Сталь, латунь, другие металлические сплавы | |
* Говорят, что две растворимые жидкости смешиваются друг с другом .
Сила решений
Растворимость — это количество растворенного вещества, которое может быть растворено в данном количестве растворителя при любой одной температуре. Считается, что раствор ненасыщенный, если растворяется больше растворенного вещества.
Разбавленный или слабый раствор — только небольшое количество растворенного вещества по сравнению с растворителем.
Концентрированный раствор — Относительно большое количество растворенного вещества превращается в растворитель.
Насыщенный раствор — На этом этапе концентрация растворенного вещества в растворе является максимально возможной при существующих условиях (температуре и давлении). Раствор становится насыщенным, когда растворенное вещество больше не может растворяться при текущей температуре. Насыщенный раствор — это раствор, в котором растворенные и нерастворенные растворенные вещества находятся в равновесии.
Перенасыщенный раствор — раствор, содержащий больше растворенного вещества, чем насыщенный раствор; раствор не находится в равновесии с чистым веществом.Примеры перенасыщенных растворов: газированная вода,
.Вода — универсальный растворитель
A Хотя воду иногда называют универсальным растворителем, есть много вещей, которые она не может растворить. Например, вода и масло не смешиваются. Мы говорим, что масло несмешивается в воде.
Что делает воду таким хорошим растворителем?
Вода является хорошим растворителем благодаря своей полярности.Свойства воды как растворителя жизненно важны для биологии, потому что многие биохимические реакции происходят только в водных растворах
Когда ионное или полярное соединение попадает в воду, оно окружается молекулами воды.




 В эту категорию выделяют безглинистые составы (техническая вода, растворы, суспензии и средства на основе полимеров), глинистые вещества (на основе пресной, минерально воде, гипсовые, глиняные и хлорные растворы).
В эту категорию выделяют безглинистые составы (техническая вода, растворы, суспензии и средства на основе полимеров), глинистые вещества (на основе пресной, минерально воде, гипсовые, глиняные и хлорные растворы).
 Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.
Например, этанол (CH 3 CH 2 OH) растворим в воде в любом соотношении, в то время как только 0,0008 мл гептанола (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) растворяется в 100 мл воды. Предложите объяснение такому поведению.